Le
tannage des peaux, traitement des effluents,
Bts Métiers de l'eau 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Partie 1. La déchromatation des efluents. 11 points
1. La déchromatation.
Le tannage du cuir nécessite de grandes quantités de chrome trivalent
(Chrome III) utilisé en large excès. On le retrouve, sous cette forme,
dans les eaux de lavages, mais également sous forme de chrome
hexavalent (Chrome VI), produit de l’oxydation du chrome trivalent par
les matières organiques lors du traitement des peaux.
La déchromatation consiste à réduire les ions dichromate Cr2O7 2– en ions Cr3+ qui pourront précipiter sous forme d’hydroxyde métallique facilement récupérable par décantation.
Le réducteur le plus couramment utilisé est l’hydrogénosulfite de sodium, NaHSO3, en milieu acide de pH égal à 4.
1.1. Définir une réaction de réduction.
Dans une réaction de réduction, un oxydant gagne un ou plusieurs électrons ; il se réduit.
1.2. Déterminer le degré d’oxydation (ou n.o.) du chrome dans les ions dichromate Cr2O7 2– et dans les ions Cr3+ impliqués dans la déchromatation.
Ion dichromate : 2 n.o(Cr )+ 7 x(-2) = -2 ; n.o(Cr) = 12 / 2 = + VI ;
ion Cr3+ : n.o(Cr) = +III.
1.3. Écrire la demi-équation électronique pour le couple SO42– (aq) / HSO3 –(aq) et donner la relation de Nernst appliquée à ce couple.
SO42– (aq) +2e- + 3H+ (aq)= HSO3 –(aq)+H2O(l).
E = E°(SO42– (aq) / HSO3 –(aq)) +0,03 log ([SO42– (aq)] [H+ (aq)]3 / [HSO3 –(aq)] ).
1.4. Montrer que l’équation de la droite frontière, entre les espèces SO42– (aq) et HSO3 –(aq) est :
E = 0,22 – 0,09 x pH
On rappelle qu’il y a égalité des concentrations des espèces SO42– (aq) et HSO3 –(aq) sur la droite frontière.
E = E°(SO42– (aq) / HSO3 –(aq)) +0,03 log ( [H+ (aq)]3 )
E = 0,22 +0,09 log [H+ (aq)] =0,22 -0,09 pH.
1.5. Tracer cette droite frontière sur le diagramme en positionnant sur le diagramme les deux espèces du couple.
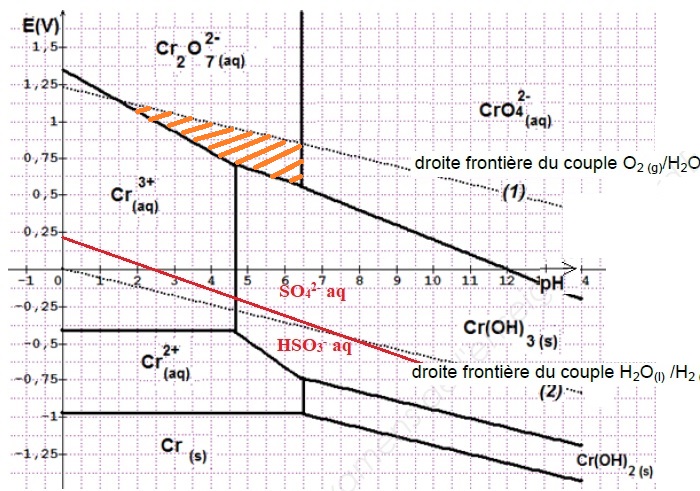
1.6. Justifier alors que HSO3– peut réduire Cr2O72– lorsque le pH est égal à 4.
A pH = 4, Cr2O72– et HSO3– appartiennent à des domaines disjoints : Cr2O72– est l'oxydant le plus fort et HSO3– est le réducteur le plus fort.
1.7. Écrire la demi-équation rédox du couple Cr2O72–/Cr3+.
Cr2O72–aq+ 14H+aq + 6e- ---> 2Cr3+aq + 7H2O(l).
1.8. En déduire l’équation bilan de la réaction de déchromatation.
Cr2O72–aq+ 14H+aq + 6e- ---> 2Cr3+aq + 7H2O(l).
3 fois { HSO3 –(aq)+H2O(l) ---> SO42– (aq) +2e- + 3H+ (aq) }
Ajouter et simplifier :
Cr2O72–aq+ 14H+aq + 6e- +3HSO3 –(aq)+3H2O(l)---> 2Cr3+aq + 7H2O(l)+ 3SO42– (aq) +6e- + 9H+ (aq)
Cr2O72–aq+ 5H+aq +3HSO3 –(aq)---> 2Cr3+aq + 4H2O(l)+ 3SO42– (aq).
1.9. Une tannerie industrielle traite chaque jour 4000 L d’eau résiduelle de concentration massique égale à 1,08 g.L–1
en ion dichromate. La concentration massique de la solution
d’hydrogénosulfite de sodium utilisée pour la réaction de réduction est
égale à 520 g.L–1 .
1.9.1.
En vous aidant du diagramme potentiel-pH du chrome, préciser dans quel
domaine de pH une solution d’ion dichromate est stable. Justifier alors
la nécessité de travailler en milieu acide.
Entre pH =1,5 et pH = 6,5, Cr2O72–aq et H2O(l) appartiennent au même domaine ( hachuré en jaune ci-dessus ).
Entre pH =1,5 et pH = 6,5, l'eau n'est pas oxydée en dioxygène par l'ion dichromate.
1.9.2.
En supposant la réaction de déchromatation totale, calculer le volume
journalier de solution d’hydrogénosulfite de sodium nécessaire pour
réduire la totalité des ions dichromates.
M(Cr2O72–) = 216,0 g / mol ; M(NaHSO3) = 104,1 g / mol.
Masse d'ion dichromate : m = 1,08 x 4000 =4320 g.
Quantité de matière correspondante : 4320 / 216,0 = 20,0 mol.
Quantité de matière d'hydrogénosulfite de sodium : 3 x 20 = 60 mol.
Masse correspondante : 30 x104,1 =6246 g.
Volume journalier de solution d’hydrogénosulfite de sodium 6246 / 520 =12,0 L.
|
...
|
|
2. pH de la solution d’hydrogénosulfite de sodium
2.1. L’ion HSO3- est un ampholyte. Définir le terme « ampholyte ».
Un ampholyte peut jouer le rôle d'un base en gagnant un proton, mais aussi le rôle d'un acide en cédant un proton..
2.2. On admet que dans cette solution, la réaction prépondérante correspond à l’équation suivante :
2 HSO3–(aq) = H2SO3 (aq) + SO32–(aq).
2.2.1. Écrire, en fonction des concentrations des espèces présentes en solution, les expressions de Ka1 et Ka2 respectivement des couples
(H2SO3 (aq) / HSO3–(aq) ) et HSO3–(aq) / SO32–(aq).
Ka1 = [HSO3–(aq)] [H3O+aq] / [H2SO3 (aq)] ; pKa1 = 1,8.
Ka2 = [SO32–(aq)] [H3O+aq] / [HSO3–(aq)] ; pKa2 = 7,2.
2.2.2. Justifier que l’expression de la concentration en ions hydronium H3O+aq en fonction de Ka1 et Ka2 est : [H3O+aq] =(Ka1 Ka2)½.
Ka1 Ka2 =[H3O+aq]2 [SO32–(aq)] / [H2SO3 (aq)].
D'après la réaction prépondérante [SO32–(aq)] = [H2SO3 (aq)].
[H3O+aq] =(Ka1 Ka2)½.
2.2.3. Calculer le pH de la solution.
log[H3O+aq] =0,5 (log Ka1 +log Ka2) ; pH = 0,5(pKa1 +pKa2) =0,5 (1,8 +7,2) =4,5.
3. Précipitation de l’hydroxyde de chrome.
Dans cette seconde étape, on ajoute de la soude NaOH pour permettre la précipitation des ions Cr3+ issus de la réduction des ions Cr2O72–.
3.1. Écrire l’équation de la précipitation de Cr(OH)3.
Cr3+aq + 3HO-aq ---> Cr(OH)3 (s).
3.2. Calculer le pH d’apparition du précipité à partir d’une solution contenant des ions Cr3+ à laconcentration C égale à 1,0 × 10–2 mol.L–1.
Comparer à la valeur lue sur le diagramme potentiel-pH. Ks(Cr(OH)3) = 10–30 .
Ks(Cr(OH)3) = [Cr3+aq] [HO-aq ]3 ; [HO-aq ]3 = 10-30 / 10-2 = 10-28 ;
[HO-aq ] =4,64 10-10 mol / L.
[H3O+aq] = 10-14 / (4,64 10-10) =2,16 10-5 mol / L ; pH ~4,7.
En accord avec la valeur lue sur le diagramme potentiel - pH.
|
....
|
Partie 2 – Une alternative à l’utilisation du chrome (4,5 points)
Une alternative plus écologique consiste à procéder à des techniques de
tannage n’utilisant pas de chrome. C’est le cas du tannage au formol ou
à la quinone.
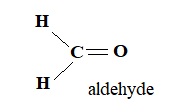
1. Le méthanal étant gazeux à température ambiante, il est dissous dans l’eau pour obtenir une solution de formol.
Représenter la formule développée du méthanal et préciser à quelle famille il appartient.
2. La dégradation du méthanal par des micro-organismes permet sa décomposition en dioxyde de carbone et méthane.
Écrire l’équation de dégradation du méthanal.
2 H2CO ---> CH4 + CO2.
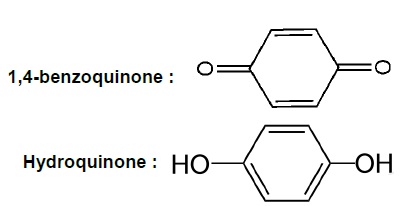
3. La 1,4-benzoquinone est une cétone non aromatique . Sa forme réduite est l’hydroquinone (benzène-1,4-diol) qui est un composé aromatique.
3.1. Justifier l’utilisation des trois termes soulignés caractérisant ces molécules.
Le cycle de la 1,4-benzoquinone compte deux doublets d'électrons. La 1,4-benzoquinone est une cétone non aromatique .
Le cycle de l'hydroquinone compte 3 doublets d'électrons conjugués. L'hydroquinone est un composé aromatique.
3.2. Par voie de
synthèse, on peut obtenir en plusieurs étapes l’hydroquinone à partir
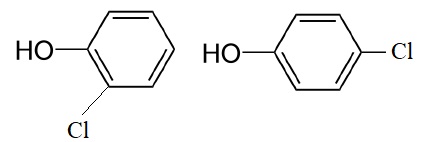
du phénol. La première étape consiste en une chloration du phénol de
formule C6H5OH en présence de chlorure d’aluminium (AlCl3).
Représenter les formules topologiques des composés organiques obtenus,
sachant que le groupe OH oriente la substitution en ortho et para.
Préciser le rôle du chlorure d’aluminium.
Le chlorure d'aluminium joue le rôle de catalyseur.
3.3. Écrire, en utilisant les formules brutes, la demi-équation du couple rédox formé par la 1,4-benzoquinone et l’hydroquinone.
C6H4O2 / C6H6O2 ; C6H4O2 +2H+ +2e- = C6H6O2 .
|
|



