L'aniline.
Réduction du nitrobenzène. Ampèrométrie.
Agrégation 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
I.
Propriétés basiques de l'aniline.
1.
Ecrire l'équation modélisant la réaction entre l'aniline et l'eau.
Déterminer la valeur de sa constante thermodynamique à l'équilibre.
Ion anilinium / aniline : pKa = 4,6.
C6H5-NH2 aq+ H2O (l)= C6H5NH3+
aq+ HO-aq.
K = [C6H5NH3+
aq] [HO-aq] / [C6H5-NH2
aq] =[C6H5NH3+
aq] [H3O+][HO-aq] / ([C6H5-NH2
aq] [H3O+])
K=Ke / Ka =10-14 / 10-4,6
=3,98 10-10~ 4,0 10-10.
On souhaite préparer une solution d'aniline. Cette solution est appelée
solution S0.
2. Donner la
signification des pictogrammes figurant sur l'étiquette du flacon
d'aniline.
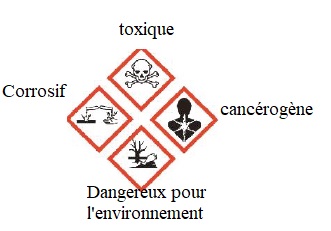
Pour préparer la solution S0, une masse m = 3,260 g
d'aniline est pesée et introduite dans une fiole jaugée de 100 mL. On
complète ensuite la fiole jaugée avec de l'eau distillée.
3. Indiquer les
principales précautions à prendre lors de la pesée de l'aniline.
Port de blouse, gants et lunette. Travailler sous hotte aspirante.
On prélève un volume V0 = 10,0 mL de solution S0
qu'on qu’on introduit dans un bécher. On ajoute alors un volume Veau
= 70 mL d’eau distillée puis un volume V1 d’acide
chlorhydrique de concentration C1 = 2,50 10-1
mol·L-1. La solution S1 obtenue est titrée par
une solution d’hydroxyde de sodium de concentration C2 =
2,50 10-1 mol·L-1.
4. Proposer des
électrodes permettant un suivi par pH-métrie du titrage décrit.
Préciser le rôle de chacune des électrodes utilisées.
Une électrode de référence au calomel saturé.
Une électrode de verre, électrode de mesure, dont le potentiel
dépend de la concentration en ion H3O+.
On donne la courbe obtenue lors du titrage de la solution S1
par une solution d’hydroxyde de sodium.
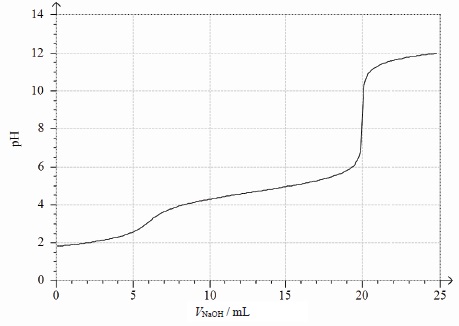
5. Écrire
l’équation de la réaction se produisant lors de l’ajout d’acide
chlorhydrique à la solution aqueuse d’aniline. Déterminer la valeur de
sa constante thermodynamique d’équilibre. En déduire la liste des
espèces présentes dans la solution S1 en observant l’allure
de la courbe de titrage.
C6H5-NH2
aq+ H3O+ aq= C6H5NH3+
aq+ H2O(l).
K = [C6H5NH3+
aq] / ([C6H5-NH2
aq] [H3O+
aq] ) = 1 / Ka = 104,6
~4,0 104.
K étant grand, la réaction est totale. L'aniline est sous forme de
cation anilinium C6H5NH3+
aq.
La courbe présentant deux sauts de pH, l'acide chlorhydrique est en
excès. Les ions H3O+aq et Cl- aq sont
présents.
6. Pour chaque domaine de la courbe
de dosage, préciser l’(ou les) équation(s) de la (ou des) réaction(s)
de titrage.
L'acide le plus fort est dosé en premier.
Premier saut de pH : H3O+aq + HO-aq
---> 2 H2O(l). K = 1 / 10-14 = 1014.
Second saut de pH : C6H5NH3+
aq +HO-aq ---> C6H5NH2
aq +H2O(l).K = Ka / Ke = 10-4,6
/ 10-14 = 109,4.
7. Déterminer le volume V1
d’acide chlorhydrique à prélever pour obtenir un volume Ve2
= 20,0 mL de solution d’hydroxyde de sodium versé à la seconde
équivalence.
En versant 20,0 mL d'hydroxyde de sodium, on dose les ion anilinium et
les ion oxonium en excès.
n(HO-) =n ( acide chlorhydrique versé) = 20,0 10-3
x0,250 = 5,00 10-3 mol.
Volume d'acide versé : V1
=5,00 10-3 / 0,250 = 20,0 mL.
8. Le volume Ve1 de
solution d’hydroxyde de sodium versé à la première équivalence est de
6,20 mL.
Conclure sur l’éventuelle dégradation de l’aniline ayant servi à la
préparation de la solution S0.
n( acide chlorhydrique en excès) =6,20 10-3 x0,250 = 1,55 10-3
mol.
n(acide chlorhydrique ayant réagit avec l'aniline) =n (aniline) =
(5-1,55) 10-3 = 3,45 10-3
mol.
Masse d'aniline dans V0 : 3,45 10-3 x M(aniline)
= 3,45 10-3 x93~0,321 g.
Masse d'aniline dans S0 : 3,21 g.
Ecart
relatif : (3,26-3,21) / 3,26 ~0,015 (1,5 %).
L'aniline est peu dégradée.
9. Déterminer la valeur du pH de la solution aqueuse contenue
dans le bécher pour Ve2 = 20,0 mL.
Le couple acide base ( ion anilinium / aniline) fixe le pH.
C6H5NH2
aq +H2O(l)--> C6H5NH3+
aq +HO-aq.
K = [C6H5NH3+
aq ] [HO-aq ] / [
C6H5NH2
aq] =10-14
/ 10-4,6 ~4,0 10-10.
C = concentration de
l'aniline + concentration ion anilinium =quantité de matière d'aniline
/ volume total.
C = 0, (20-6,2) 10-3 / (0,010+0,020+0,030 +0.070)=2,88 10-2
mol/ L.
x : concentration de l'ion anilinium = [HO- aq]
4,0 10-10 = x2 /(C-x) ~x2 / C soit x =
3,4 10-6 mol/ L.
[H3O+aq] = 10-14
/ (3,4 10-6)
=2,9 10-9 mol/L ; pH = 8,5.
10. Justifier le
choix de la phénolphtaléine comme indicateur coloré acido-basique pour
mettre en évidence la fin du second titrage.
La zone de virage de l'indicateur coloré doit contenir le pH du point
équivalent.
Le pH du point équivalent appartient à la zone de virage de la
phénolphtaléine [8,4 ; 10,4 ]
11.
Pour améliorer la précision du dosage étudié, proposer une autre
méthode de suivi du titrage. Expliquer succinctement la réponse.
Lors d'un titrage par conductimétrie, le graphe est constitué de
segments de droite. La détermination du premier point d'équivalence (
intersection de deus droites ) sera plus précis.
|
...
|
|
Préparation
de l'aniline par réduction du nitrobenzène.
La synthèse du chlorure d’anilinium C6H5-NH3Cl
à partir de nitrobenzène C6H5-NO2 est
effectuée selon le mode opératoire suivant :
Introduire dans un ballon bicol de 500 mL, surmonté d’un réfrigérant à
eau et d’une ampoule de coulée, 31 g (0,25 mol) de nitrobenzène et 45 g
d’étain, Sn(s). Introduire 220 mL d’acide chlorhydrique concentré (37 %
en masse, densité d = 1,2 à 25 °C) dans l’ampoule de coulée. Ajouter
goutte à goutte, sous agitation vigoureuse, l’acide chlorhydrique de
façon à observer une ébullition modérée du milieu réactionnel. Prévoir
éventuellement un bain d’eau glacée. Lorsque l’addition d’acide
chlorhydrique est terminée, porter à reflux 45 min puis laisser
refroidir le mélange à température ambiante.
12.
Écrire l’équation de la réaction mise en jeu lors de la synthèse du
chlorure d’anilinium en considérant les couples d’oxydoréduction
suivants : C6H5-NO2 / C6H5-NH3Cl
et [SnCl6]2-/Sn.
Oxydation : 3 fois { Sn +6 Cl- = [SnCl6]2-+
4e- }
Réduction : 2 fois {C6H5-NO2
+ 7H++Cl - +6e- = C6H5-NH3Cl
+2H2O }.
3Sn +2C6H5-NO2
+ 14H+ + 20 Cl- = 3[SnCl6]2-+ 2C6H5-NH3Cl
+4H2O.
13.
Calculer toutes les quantités initiales de réactifs non indiquées dans
le protocole. En déduire la quantité de chlorure d’anilinium attendue
en supposant que la réaction précédente est totale.
n(étain) = 45 / M(Sn) = 45 / 118,7 =0,38 mol.
Acide
chlorhydrique :
masse de 1 L de solution : 1,2 kg ; masse d'acide pur : 1,2 x 0,37 =
0,444 kg
Quantité de matière de cet acide : 444 / 36,5 = 12,16 mol / L.
Quantité de matière d'acide chmorhydrique : 0,220 x 12,16 = 2,68 ~2,7
mol.
La réduction de 0,25 mol de nitrobenzène nécessite 0,25 x1,5 0,375 mol
d'étain, 2,5 mol d'ion chlorure et 1,75 mol d'ion H+.
Le nitrobenzène est le ractif limitant. On obtiendra 0,25 mol de
chlorure d'anilinium soit 0,25 ( 6 x12 +8+14+35,5) ~32,4 g.
Le milieu réactionnel obtenu au terme de la synthèse est traité de la
façon suivante :
Lorsque le mélange est à température ambiante, ajouter une solution de
75 g d’hydroxyde de sodium dans 125 mL d’eau. L’aniline présente dans
le milieu est extraite par entraînement à la vapeur d’eau. Le distillat
obtenu est saturé par du chlorure de sodium solide puis extrait par 3
fois 40 mL d’éther diéthylique. L’ensemble des phases organiques est
séché par du carbonate de potassium K2CO3 anhydre.
Après filtration, l’éther diéthylique est éliminé à l’aide d’un
évaporateur rotatif et l’aniline obtenue est caractérisée par la mesure
de son indice de réfraction.
14. Déterminer la
masse d’aniline théoriquement attendue à la fin de la synthèse.
n(soude) = 75 / (NaOH) = 75 / 40 ~1,9 mol.
La soude est en large excès : elle neutralise l'excès d'acide
chlorhydrique et transforme la totalité de l'ion anilinium en aniline.
Masse d'aniline : 0,25 x M(aniline) = 0,25 x 93 ~23 g.
15. Représenter et
légender le montage utilisé pour réaliser l’extraction de l’aniline par
entraînement à la vapeur d’eau.
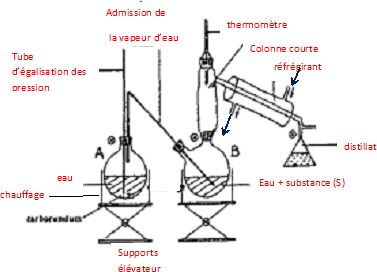
Sous
P = 1013 hPa, le mélange eau-aniline présente un hétéroazéotrope
caractérisé par T = 98,6 °C et une fraction molaire en aniline xaniline
= 0,044.
16. Représenter
l’allure du diagramme binaire liquide/vapeur eau-aniline T = f(xaniline)
sous P = 1013 hPa.
Pour simplifier, on supposera dans cette question que l’eau et
l’aniline sont totalement non miscibles à l’état liquide. Pour chacune
des différentes zones du diagramme, indiquer le nombre de phases et les
espèces présentes dans chaque phase.
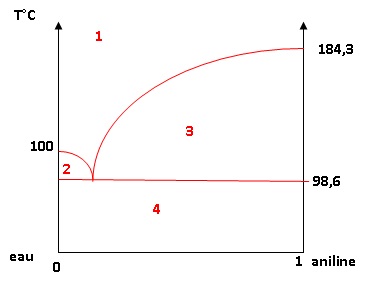
1 : vapeur eau et analine.
2. vapeur eau + aniline et eau liquide.
3 : vapeur eau + aniline et aniline liquide.
4 : eau et aniline liquides.
17. La courbe
d’analyse thermique (refroidissement de 150 °C à 80 °C sous 1013 hPa)
d’un mélange eau-aniline à la composition hétéroazéotropique présente
un palier horizontal. Justifier l’existence de ce palier par un calcul
du nombre de degrés de liberté.
Le système est constitué de l'eau ( liquide et vapeur) et de l'aniline
( liquide et vapeur).
La pression est fixée à 1013 hPa.
Les paramètres intensifs sont : la température T et les fractions
molaires xV eau , xLeau, xVaniline
et xLaniline.
Relations entre ces grandeurs : xV eau
+ xVaniline
= 1 ; xLeau=
xLaniline
=1.
H2O (liquide) = H2O(vapeur) ; PH-NH2 (
liquide) = Ph-NH2(vapeur).
Variance = Nombre de paramètres intensifs - nombre de relations entre
eux = 0.
Il n'y a aucun degré de liberté, la température est constante ( d'où un
palier).
18.
Déterminer la masse minimale d’eau permettant de récupérer la totalité
de l’aniline lors de la réalisation de l’entraînement à la vapeur d’eau
décrit dans le protocole de la synthèse.
0,25 mol d'aniline sont entraîné par la vapeur d'eau. La fraction
molaire de l'aniline xaniline est égale = 0,044.
xaniline = naniline / (naniline + neau)
; 0,044 = 0,25 / (0,25 +neau) ; neau = 5,4 mol
soit 5,4 x18 = 98 g d'eau..
|
....
|
19.
La solution éthérée d’aniline est séchée à l’aide de carbonate de
potassium anhydre alors que l’agent desséchant le plus couramment
utilisé est le sulfate de magnésium MgSO4 anhydre. Proposer
une explication au fait qu’il est déconseillé d’utiliser MgSO4
dans la situation présente.
Le doublet non liant de l'atome d'azote peut conduire à un complexe
avec l'ion magnésium.
La teneur résiduelle en eau dans l’aniline préparée se détermine grâce
à un titrage de l’eau selon la méthode de Karl Fischer. Cette méthode
repose sur la réduction du diiode par le dioxyde de soufre, réduction
qui nécessite la présence d’eau. Dans un souci de simplification, les
états physiques des différentes espèces ne sont pas mentionnés, et la
transformation est modélisée par l’équation ci-dessous :
I2 + SO2 + 2 H2O → 2 HI + H2SO4.
En pratique, à l’aide d’une burette automatique, on ajoute le réactif
titrant de Karl Fischer (réactif contenant I2 et SO2
en solution dans le méthanol CH3OH) dans l’échantillon dont
on cherche à déterminer la composition massique en eau.
20. Dans le cas où
l’échantillon à doser est incolore, indiquer et expliquer le changement
de couleur observé à l’équivalence du titrage de l’eau.
Avant
l'équivalence : eau en excès et diiode en défaut, solution
incolore.
Après
l'équivalence : eau en défaut et diiode en excès, la solution
prend la couleur de la solution titrante.
Pour augmenter la précision de détection de l’équivalence, le dosage de
l’eau peut être suivi par ampérométrie à deux électrodes en platine. On
impose une tension fixe entre les deux électrodes et on mesure
l’intensité du courant électrique au cours du titrage. Dans le cas du
titrage de l’eau par la méthode de Karl Fischer, la valeur choisie pour
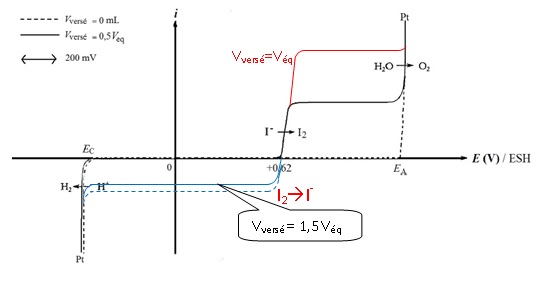
la tension est ΔE = 200 mV.
Pour déterminer comment est repérée l’équivalence au cours d’un titrage
suivi par ampérométrie, on s’intéresse dans un premier temps au dosage
du dioxyde de soufre par le diiode en milieu aqueux à pH = 7. Plus
précisément, on étudie les courbes courant-potentiel i = f(E) des
solutions obtenues au cours du titrage pour différents volumes versés
de solution de diiode.
En annexe, en fin d’énoncé ; sont représentées deux courbes
courant-potentiel. Une des courbes correspond à la situation observée
pour un volume versé de solution de diiode Vversé = 0 mL et
la seconde courbe correspond à la situation observée pour Vversé
= 0,5 Veq, Veq étant le volume versé à
l’équivalence du titrage.
Les courbes sont tracées dans l’hypothèse où le système I2/I-
sur électrode de platine est rapide. Les coefficients de diffusion des
espèces I2 et I- sont supposés égaux. Les espèces
soufrées sont électrochimiquement inertes.
21. Expliquer ce
que signifie « le système I2/I- sur électrode de
platine est rapide ».
Le système étant rapide, au niveau de l'électrode, le transfert des
charges n'est pas cinétiquement limitant.
22. Déterminer les
valeurs des potentiels notés EA et EC sur la
figure. On prendra p(O2) = p(H2) = 1 bar et T =
298 K.

2H2O = O2 + 4H+ +4e-.
E = E°(O2 / H2O) +0,06 / 4 log(PO2 [H+]4)=1,23
-0,06pH = 1,23 -0,06 x7 =0,81 V.
EA est égal au potentiel de Nernst auquel il faut ajouter la
surtension anodique sur électrode de platine.
EA = 0,81 +0,50 = 1,31 V.
2H+ +2e-= H2 .
E = E°(H+ / H2) +0,06 / 2 log( [H+]2/
pH2)=0 -0,06pH = 0 -0,06 x7 = -0,42 V.
EC est égal au potentiel de Nernst auquel il faut ajouter la
surtension cathodique sur électrode de platine.
EC = -0,42 -0,09 = -0,51 V.
23. Interpréter
l’existence d’un palier horizontal pour la vague anodique d’oxydation
des ions iodure, représentée sur la figure.
La diffusion des ions iodure limite le courant anodique.
24. Compléter le
faisceau de courbes courant-potentiel de la figure par les
courbes courant-potentiel pour Vversé = Veq, pour
Vversé = 1,5 Veq et pour Vversé = 1,75
Veq. On considèrera que le potentiel à courant nul varie peu
au cours du titrage et reste sensiblement proche de 0,62 V.
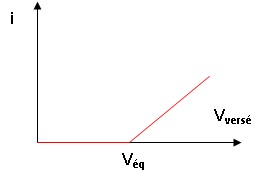
25. Pour une
tension imposée ΔE = 200 mV, représenter l’allure de la courbe i =
f(Vversé) observée au cours du titrage du dioxyde de soufre par le
diiode.
L'intensité du courant est nulle tant qu'il y a de l'eau.
Quand il n'y a plus d'eau, le diiode est en excès et l'intensité du
courant croît.
Avant
l'équivalence : on ne peut pas placer DE sur les courbes
permettant d'observer une oxydation et un réduction. L'intensité du
courant est nulle.
Après
l'équivalence : on peut placer DE sur les courbes
permettant d'observer un courant anodique égal en valeur absolue au
courant cathodique. L'intensité du courant croît.
Le fait de travailler en milieu aqueux,
plutôt que dans le méthanol comme c’est le cas lors d’un titrage selon
Karl Fischer, permet une construction plus simple des courbes
courant-potentiel, sans pour autant modifier les conclusions obtenues.
26. Expliquer alors
comment est repérée l’équivalence lors du dosage de l’eau par la
méthode de Karl Fischer si le titrage est suivi par ampérométrie à deux
électrodes.
|
|
|
|






