Chimie,
Concours ESA 2018 ( école de santé des armées).
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
QCM 1
Concernant la molécule représentée ci-dessous, cocher l’affirmation exacte :
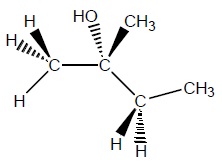 A.
A. Elle ne contient aucun carbone asymétrique. Vrai.
B. Elle contient un seul carbone asymétrique
C. Elle contient exactement deux carbones asymétriques
D. Elle contient exactement trois carbones asymétriques
E. Aucune réponse juste.
QCM 2.
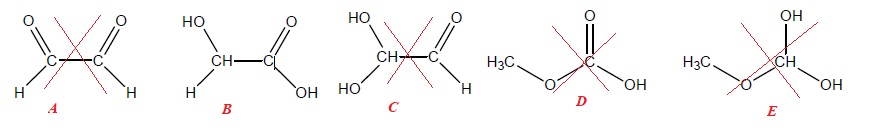
Parmi les 5 molécules suivantes, laquelle (ou lesquelles) est(sont) chirale(s) ?
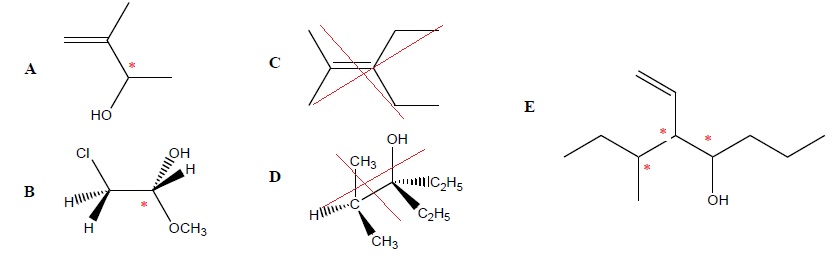 QCM 3
QCM 3.
Parmi les représentations suivantes, laquelle (ou lesquelles) représente(nt) correctement la molécule ci-dessous :
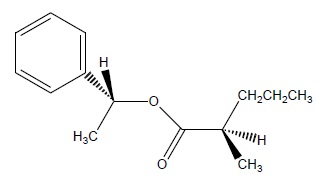
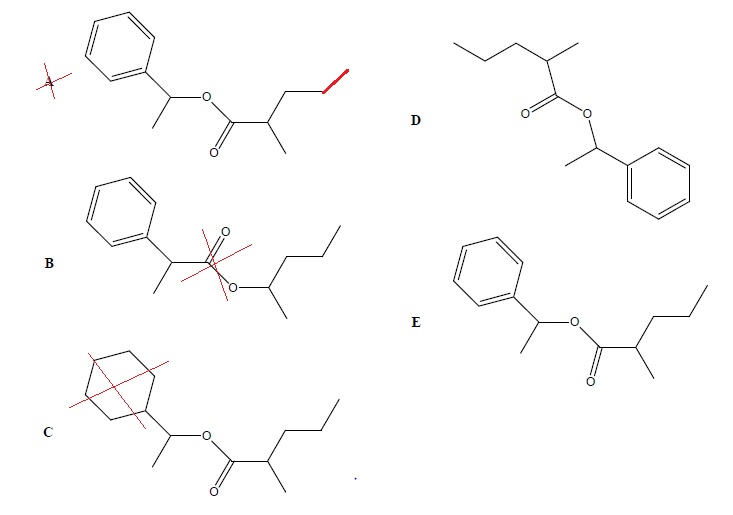
|
...
|
|
QCM 4.
Soient les représentations 1 à 5 ci-dessous, cocher la(ou les) affirmation(s) exacte(s) :
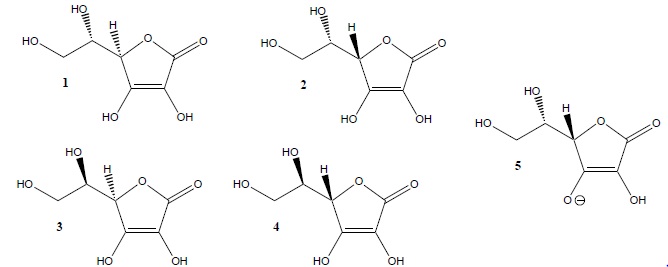
A. 1 et 2 forment un couple de diastéréoisoméres. Vrai.
Un seul des deux carbones asymétriques change de configuration.
B. 1 et 4 forment un couple d’énantiomères. Vrai.
Les deux carbones asymétriques changent de configuration.
C. 1 et 3 forment un couple de diastéréoisoméres. Vrai.
Un seul des deux carbones asymétriques change de configuration.
D. 2 et 5 sont identiques. Faux.
L'un des atomes d'oxygène de 5 porte une charge négative ( anion), contrairement à 2..
E. 4 et 5 forment un couple de diastéréoisoméres. Faux.
QCM 5.
Parmi les 5 représentations ci-dessous, indiquer laquelle (ou lesquelles)
correspond(ent) à une représentation de Cram de la molécule ci-contre :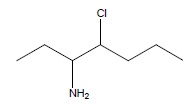
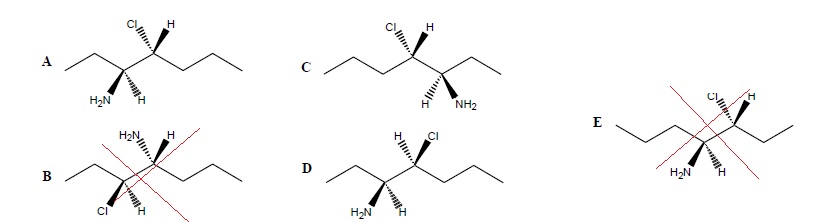
QCM 6.
Identifier le ou les groupe(s) caractéristique(s) présent(s) dans la molécule d’aldostérone cidessous.
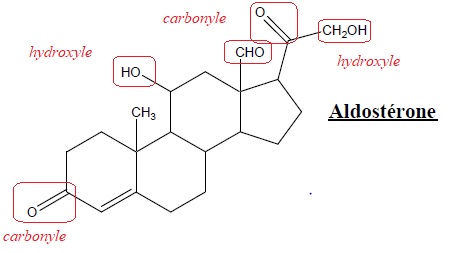
A. Ester ; B. Hydroxyle ; C. Carbonyle ; D. Acide carboxylique ; E. Amide.
QCM 7
Parmi les propositions suivantes, cocher la (ou les) réponse(s) vraie(s) :
A. L’acide 3-méthylbutanoïque possède une double liaison C=N. Faux.
(CH3)2-CH2-COOH.
B. Le 2-éthylpentanamide possède une double liaison C=C. Faux.
CH3-CH2-CH2-CH(C2H5)-CO-NH2.
C. Le propanoate d’éthyle est issu de la réaction entre l’acide éthanoïque et le propanol. Faux.
Entre l'acide propanoïque et l'éthanol.
D. Le 2,2-diéthylbutanoate de propyle est un ester. Vrai.
(C2H5)3C-CO-O-CH2-CH2-CH3.
E. L’éthanamine présente un groupe C=O. Faux.
CH3-CH2-NH2.
Soient les réactions numérotées de 1 à 5 ci-dessous :
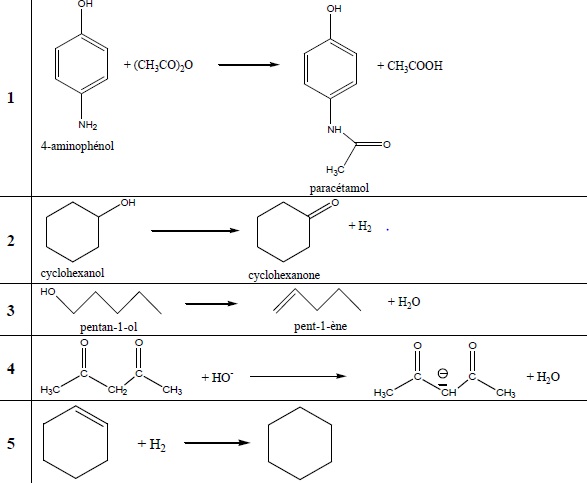
QCM 8.
Cocher la (ou les) affirmation(s) exacte(s) :
A. La réaction 1 correspond à une modification de groupe. Vrai.
Passage d'une amine (NH2) à un amide NH-CO-CH3.
B. La réaction 2 correspond à une modification de chaine. Faux.
Oxydation d'un alcool primaire en cétone.
C. La réaction 3 correspond à une modification de chaine. Faux.
Déshydratation d'un alcool primaire.
D. La réaction 4 correspond à une modification de groupe. Faux.
Réaction acide base.
E. La réaction 5 correspond à une modification de chaine. Faux.
Le cycle à 6 atomes de carbone est conservé.
QCM 9.
Cocher la (ou les) affirmation(s) exacte(s) :
A. La réaction 1 résulte d’un mécanisme de substitution. Vrai.
NH -CO-CH3 est substitué à H.
B. La réaction 2 résulte d’un mécanisme d’élimination
C. La réaction 3 résulte d’un mécanisme d’addition
D. La réaction 4 résulte d’un mécanisme d’élimination
E. La réaction 5 résulte d’un mécanisme d’addition. Vrai.
Addition de H2 sur une double liaison C=C.
:
|
....
|
QCM 10.
Indiquer
la(ou les) proposition(s) pour laquelle(lesquelles) la polarisation
indiquée sur la liaison est correcte (indépendamment du reste de la
molécule) :
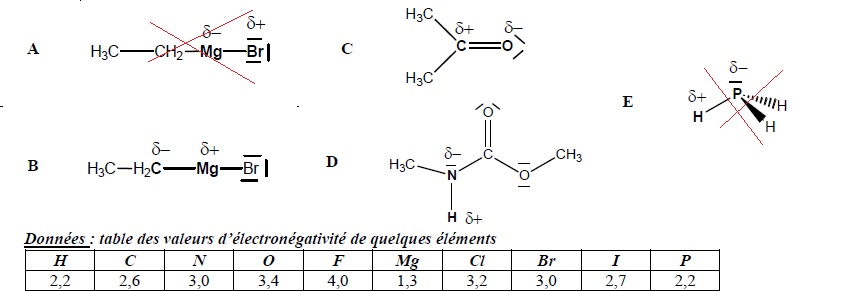
QCM 11.
A propos du mécanisme réactionnel ci-dessous, cocher la(ou les) affirmation(s) exacte(s) :
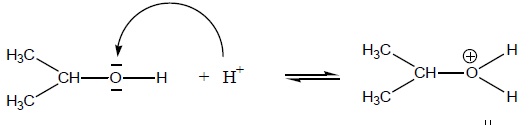
A. L’atome d’oxygène est un site accepteur. Faux.
B. Le proton H+ est un site donneur. Faux.
C. La flèche courbe doit normalement représenter le mouvement d’un doublet d’électrons. Vrai.
D. Le sens de la flèche courbe de ce mécanisme est correct. Faux.
Elle doit partir d'un doublet de l'oxygène et aller vers le proton.
E. La flèche courbe doit partir du site donneur et aboutir au site accepteur. Vrai.
QCM 12.
Soit la réaction ci-dessous, cocher la ou les affirmation(s) exacte(s) :
CH3-COO-(aq) + H3O+(aq= CH3-COOH(aq) + H2O(l)
A. De gauche à droite, l’espèce CH3-COO- joue le rôle de base. Vrai.
B. De droite à gauche, l’espèce H2O joue le rôle de base. Vrai.
C. Selon la théorie de Brönsted, un acide est une espèce capable de capter un ion hydrogène H+. Faux.
D. De droite à gauche, l’espèce CH3-COOH capte un ion hydrogène H+ de la molécule d’eau. Faux.
E. De gauche à droite, l’espèce H3O+ cède un ion hydrogène H+. Vrai.
On considère les équations de dissolution dans l’eau de quelques espèces acides ou basiques :
HCl(aq) + H2O(l) --> H3O+(aq) + Cl-(aq)
CH3COOH(aq) + H2O(l) --> CH3COO-(aq) + H3O+(aq)
S2-(aq) + H2O(l) --> HS-(aq) + HO-(aq).
QCM 13.
Cocher la(ou les) affirmation(s) exacte(s) :
A. L’acide chlorhydrique HCl est un acide fort. Vrai.
B. S2- est une base faible. Vrai.
C. CH3COOH est un acide faible. Vrai.
D. CH3COO- est une base forte. Faux.
E. Aucune réponse juste parmi les propositions précédentes
QCM 14 :
Cochez la (ou les) affirmation(s) exacte(s) :
A. Le pH d’une solution d’HCl de concentration 0,01 mol.L-1 vaut 0. Faux.
pH = -log (0,01) = 2.
B. Le pH d’une solution de CH3COOH de concentration 0,01 mol.L-1 vaut 2. Faux.
L'acide éthanoïque est un acide faible. pH > 2.
C. Le pH d’une solution de S2- à 10-3 mol.L-1 vaut 11. Faux.
S2- est une base faible. pH < 11.
D. Si on dilue 10 fois une solution de HCl à 0,01 mol.L-1 alors son pH diminue de 1 unité. Faux.
Le pH augmente d'une unité.
E. Aucune réponse juste parmi les propositions précédentes. Vrai.
|
QCM 15.
L’acide glycolique a pour formule brute C2H4O3 ; son spectre IR est donné ci-dessous :
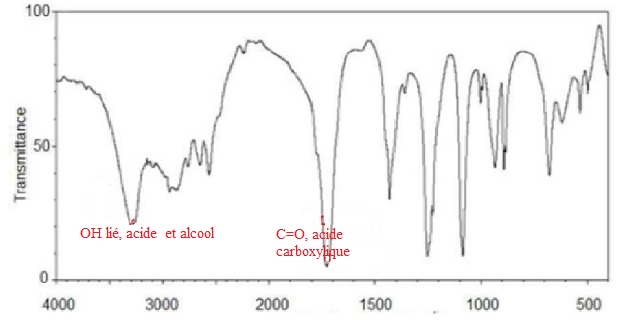
Cocher la (ou les) affirmation(s) exacte(s) :
A. L’acide glycolique peut posséder une fonction alcool. Vrai.
B. Le spectre révèle la présence d’au moins un groupement hydroxyle O-H. Vrai.
C. Ce spectre utilise des radiations de longueurs d’ondes supérieures à 800 nm. Vrai.
1/l= 500 cm-1; l = 1/500 =2 10-3 cm = 2 10-5 m =2 104 nm.
1/l= 4000 cm-1; l = 1/4000 =2,5 10-4 cm = 2,5 10-6 m =2,5 103 nm.
D. Ce spectre IR est un spectre d’émission. Faux ( absorption ).
E. Le spectre révèle la présence d’un groupement carbonyle C=O caractéristique de la fonction cétone. Faux.
QCM 16.
Sachant que le spectre RMN de l’acide glycolique ne comporte que trois signaux :
- deux singulets intégrant chacun pour 1H
- un singulet intégrant pour 2H
Déterminer avec ces informations et la question précédente, la formule de l’acide glycolique :
QCM 17.
En solution aqueuse, l’acide aminé cystéine peut exister sous 4 formes
différentes notées de 1 à 4 ci-dessous en fonction du pH du milieu :
A partir de ces données, déterminer le diagramme de prédominance correct pour la cystéine.

QCM 18.
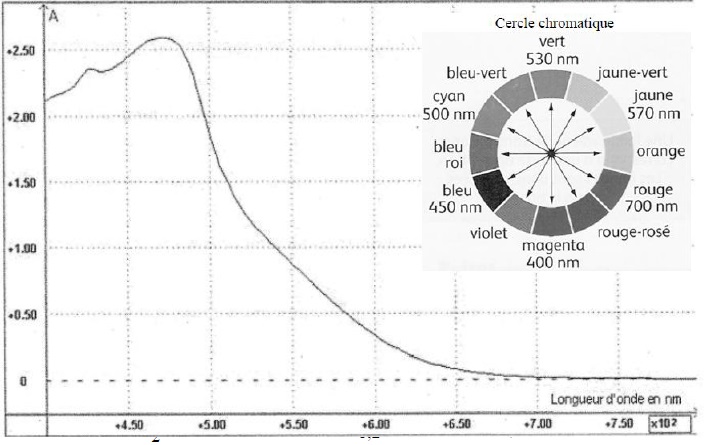
Soit le spectre d’absorption d’une solution aqueuse de diiode de concentration molaire c = 3,00.10-3 mol.L-1 :
Données :
Loi de Beer Lambert : A = e.L.c
A est l’absorbance, sans unité
e est le coefficient d’extinction molaire en L.cm-1.mol-1.
L est la largeur de la solution traversée, en cm
c est la concentration de la solution étudiée, en mol.L-1.
Cocher la (ou les) affirmation(s) exacte(s) :
A. L’absorbance maximale se fait dans le domaine des UV. Faux.
L'absorbance maximale est observée à 470 nm = 0,47 µm ( domaine visible : bleu roi )
B. La solution de diiode est de couleur jaune. Faux.
La couleur complémebtaire du bleu roi et l'orangé.
C. Dans une cuve de largeur L= 1,00 cm, le coefficient d’extinction molaire vaut environ 800 L.cm-1.mol-1 à 450 nm. Vrai.
A = 2,4 = e x3 ,00 10-3 ; e = 2,4 /(3 10-3) = 800 L.cm-1.mol-1.
D. Si on utilise une cuve de largeur L’ = 2.L on double λmax. Faux.
E. Si on utilise une solution de concentration c’ = c/2 alors l’absorbance est divisée par 2. Vrai.
Une fois solubilisée dans l’eau, une quantité initiale n0 (en moles) de CO2(g) est hydratée en dihydrogénocarbonate H2CO3 selon la réaction (1) ci-dessous :
(1) CO2(aq) + H2O(l) = H2CO3(aq) à raison de 0,03 molécule de CO2 par seconde
En milieu biologique, cette réaction est effectuée sur la même quantité n0 par l’anhydrase carbonique (cas (2)) à l’aide d’un cofacteur métallique, l’ion zinc (II) noté Zn2+ à raison de 3.104 molécules de CO2 par seconde.
QCM 19 :
Cocher la (ou les) affirmation(s) exacte(s) :
A. L’anhydrase carbonique joue le rôle de catalyseur en milieu biologique. Vrai.
B. L’anhydrase carbonique augmente la cinétique de la réaction d’un facteur 106. Vrai.
3 104 / 0,03 = 106.
C. Si la réaction ne se déroulait pas dans l’eau la cinétique de la réaction serait identique. Faux.
D. En augmentant uniquement la température de la réaction (1) la cinétique serait augmentée. Vrai.
E. Lorsque l’avancement a atteint sa valeur finale xf, on retrouve plus de molécules H2CO3(aq) dans le milieu biologique que dans la situation de la réaction (1). Faux.
Un catalyseur permet d'atteindre plus rapidement l'équilibre, sans en modifier la composition.
QCM 20 :
La quantité de matière de H2CO3(aq) (n en mmol)
formée est mesurée au cours du temps (t en secondes) dans le cas (1) de
la question précédente et représentée ci-dessous :
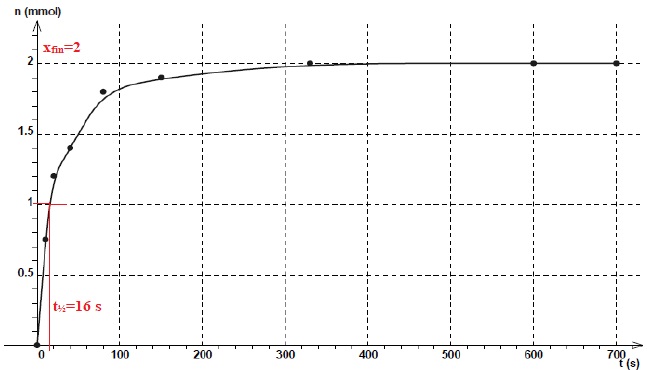
Cocher la (ou les) affirmation(s) exacte(s) :
A. A t=t1/2 la moitié de la quantité initiale de réactif limitant est consommée. Faux.
B. Le temps de demi-réaction est le temps au bout duquel l’avancement x est égal à xmax/2. Faux.
A t½, l'avancement est égal à xfin / 2.
C. Il faut attendre 40 s pour consommer 1,4.10-3 mol de H2CO3(aq). Vrai.
A t =40 s, l'avancement est égal à 1,4 mmol.
D. Le temps de demi-réaction est environ de 350 s. Faux.
E. Une augmentation de la température augmente le temps de demi-réaction. Faux ( diminue t½).
|
|
|