Degré
d'hydratation du chlorure de magnésium, bac Métropole 2021.
Conductimétrie.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
...
|
.
.
|
..
..
......
...
|
Des
sachets de chlorure de magnésium sont disponibles en pharmacie et
permettent un apport complémentaire en magnésium au corps humain. La
poudre est du chlorure de magnésium hydraté pur MgCl2, 4,5 H2O.
4,5 est appelé degré d'hydratation.
Le sachet est dissous pour fabriquer 1,00 L de solution aqueuse S1.
Une solution aqueuse S2 est obtenue par dilution d'un
facteur 5 de la solution S1.
1. Ecrire
l'équation modélisant la dissolution de la poudre du sachet dans l'eau.
MgCl2, 4,5 H2O
--> Mg2+ aq + 2Cl-aq +4,5 H2O.
2.
Décrire un protocole à mettre en oeuvre pour préparer 100,0 mL de
solution S2.
Prélever 20,0 mL de solution S1 à l'aide d'une pipette
jaugée.
Verser dans une fiole jaugée de 100,0 mL.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter pour rendre homogène.
Un titrage de la solution S2 est
réalisé par une solution S titrante de nitrate d'argent à la
concentration Cs = 5,0 10-2 mol / L. Un volume V2
= 10,0 mL de solution S2
est prélevée, versée dans un becher, auquel on ajoute 200 mL d'eau
distillée. L'ensemble est titré par la solution aqueuse S et suivi par
conductimétrie.
Réaction support du titrage : Ag+aq + Cl-aq
--> AgCl(s).
3. Les ions nitrate et chlorure sont
des espèces spectatrices lors du titrage. Que signifie " spectatrices" ?
Ces
ions ne participent pas à la réaction chimique, support du titrage. Ils
sont présents et assurent l'électroneutralité de la solution.
La conductivité s
de la solution du becher est mesurée après chaque ajout de solution
titrante.
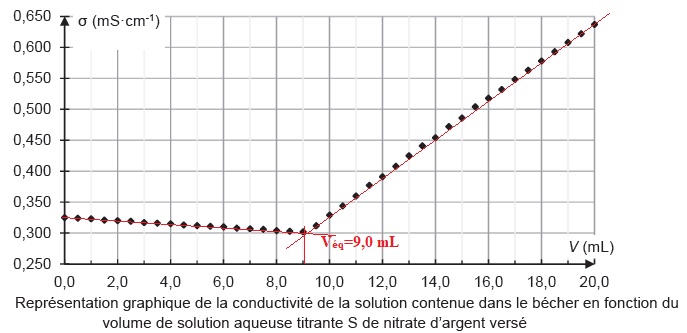
4. Justifier l'allure de la courbe.
Avant l'équivalence, Ag+ est en défaut.
Du point de vue de la conductimétrie, tout se passe comme si on
remplaçait des ions chlorure par des ions nitrate de conductivité
molaire ionique moindre.
s
diminue lentement.
Après l'équivalence, Ag+ est en excès. On ajoute des ions
nitrate et argent à la solution.
s augmente rapidement.
5.
Calculer la concentration en ion chlorure en solution S1
puis montrer que la masse de chlorure de magnésium dans le sachet est
10,8 g.
A l'équivalence : [Cl- ] V2=n(Ag+) = Véq
Cs ; [Cl- ] =
9,0 / 10 x5,0 10-2 = 4,5 10-2 mol / L.
[Mg2+] = 0,5 [Cl- ]
= 2,25 10-2 mol.
Tenir compte de la dilution : 5 x2,25 10-2 =0,1125 mol / L
[MgCl2] = 0,1125 mol / L
M(MgCl2) =95,3 g / mol
m(MgCl2)=0,1125 x95,3 =10,72 ~10,8 g.
6. En déduire le degré
d'hydratation. Conclure.
Masse de poudre dans le sachet : m = 20,3 g.
masse d'eau :
20,3-10,8 =9,5 g.
Soit 9,5 /18 ~0,53 mol d'eau.
Degré d'huydratation : 0,53 / 0,1125 ~4,7.
Ecart relatif :(4,7-4,5) / 4,5 ~0,044 ( 4,4 %).
A 4,4 % près, le degré d'hydratation est correct.
|