L'acide
lactique à la base de composés verts, bac Polynésie 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
A. Etude du caractère acide de l'acide lactique.
1. Justifier le nom acide 2-hydroxypropanoïque.
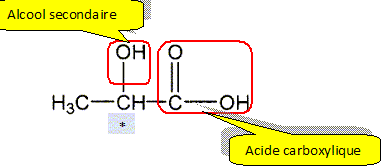
La chaine principale compte 3 atomes de carbone ; " propan";
il s'agit d'un acide carboxylique : acide propanoïque ;
un groupe hydroxy OH est fixé sur le carbone n° 2 : acide 2-hydroxypropanoïque.
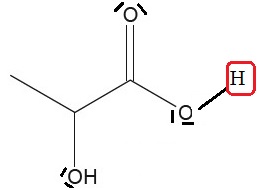
2.
Donner le schéma de Lewis de l'acide lactique. Identifier en
l'entourant l'atome d'hydrogène responsable de l'acidité de la
molécule.
3 Ecrire la formule topologique de l'ion lactate, base conjuguée de l'acide lactique.
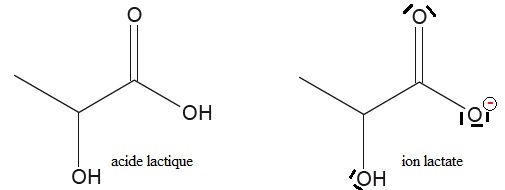
On notera par la suite HA l'acide lactique et A- l'ion lactate. Le pH d'un lait est égal à 6,4.
4. Pour ce lait calculer la concentration en ion oxonium.
[H3O+aq] =10-pH = 10-6,4 ~4,0 10-7 mol / L.
5. Etablir l'équattion de la réaction de l'acide HA avec l'eau et exprimer la constante d'acidité Ka du couple HA / A-.
HA aq + H2O(l) =A-aq + H3O+aq.
Ka =[H3O+aq] [A-aq] / [HA aq].
6. Retrouver la relation : pH = pKa + log ( [A-aq]/ [HA aq]).
log
Ka =log[H3O+aq] + log ( [A-aq] / [HA aq] ).
log[H3O+aq] = log
Ka -log ( [A-aq] / [HA aq] ).
-log[H3O+aq] = -log
Ka +log ( [A-aq] / [HA aq] ).
pH = pKa + log ( [A-aq]/ [HA aq]).
7. Calculer le rapport [A-aq]/ [HA aq] dans ce lait dont la valeur du pH est 6,4. En déduire l'espèce dominante.
pKa ( acide lactique / ion lactate) = 3,9.
log ( [A-aq]/ [HA aq]) = pH-pKa = 6,4-3,9 =2,5.
[A-aq]/ [HA aq] = 102,5 ~ 3,2 102.
[A-aq] = 3,2 102 [HA aq] est majoritaire.
8. Tracer le diagramme de prédominance du couple AH / A-.

9. A l'aide de ce diagramme, vérifier que l'espèce prédominante dans ce lait est en accord avec la réponse à la question 7.
A pH supérieur à pKa, A- est majoritaire.
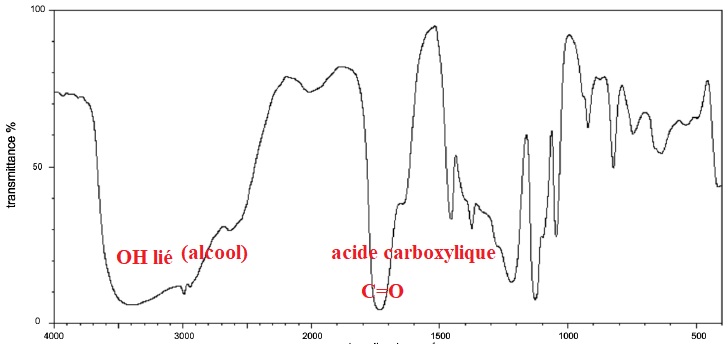
A l'aide du spectre infrarouge suivant,
justifier la présence de deux liaisons caratéristiques de la molécule
d'acide lactique.
|
...
|
....
|
B. La synthèse du lactide.
1. Identifier B.
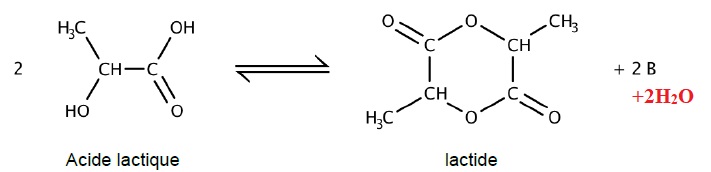
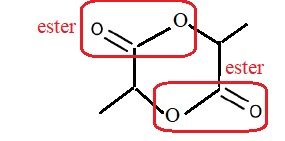
2 et 3. Ecrire la formule topologique de la molécule de lactide. Entourer et nommer la fonction chimique présente dans cette molécule.
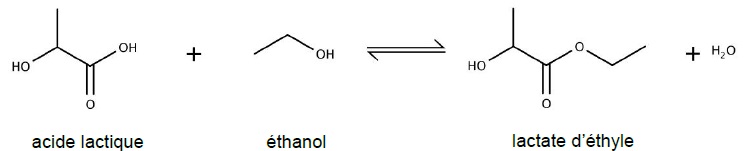
C. L'acide lactique : réactif de la synthèse du lactate d'éthyle.
Le lactate d'éthyle est synthétisé par action de l'éthanol sur l'acide lactique. L'eau est un sous produit de la réaction.
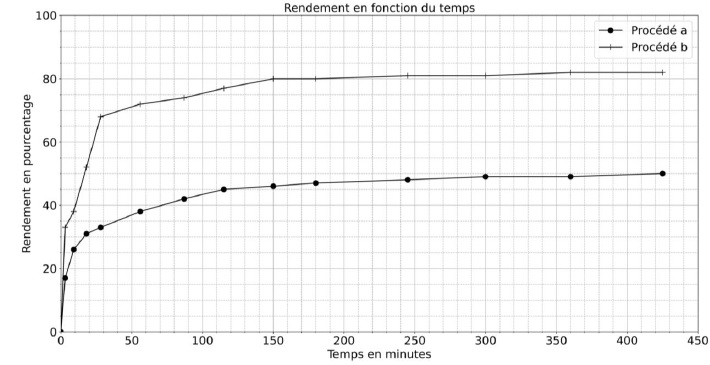
Procédé a
: la synthèse est effectuée dans un ballon équipé d'un
réfrigérant. Les quantités suivantes de réactifs sont introduites dans
le réacteur : 66,7 g d'éthanol, 39,1 g d'acide lactique, 0,33 g d'acide
sulfurique. Le milieu est agité et porté à 80°C. Le rendement en
lactate d'éthyle en fonction de la durée de la réaction est représenté.
Procédé b : la synthèse est réalisée de la même manière que pour le procédé a mais en ajoutant un solvant d'extraction aux réactifs. Le rendement en lactate d'éthyle en fonction de la durée de la réaction est représenté.
1. Vérifier que l'éthanol est en excès dans les deux procédés.
M(éthanol) = 46,0 g / mol ; n=masse étahnol / M(éthanol) = 66,7 / 46,0 =1,45 mol.
M(acide lactique) = 90,0 g / mol : n1 = masse acide lactique / m(acide lactique) = 39,1 / 90 = 0,434 mol.
Une mole d'éthanol réagit avec une mole d'acide lactique : l'éthanol est donc en excès.
2. Calculer la masse de lactate d'éthyle que l'on pourrait obtenir si la transformation était totale.
nla = n1 = 0,434 mol.
M (lactate d'éthyle) = 118 g / mol.
mla =0,434 x 118 = 51,3 g.
3. Quel est le procédé le plus efficace ?
Procédé a : 50 % ; procédé b : 82 %.
Le procédé b est donc le plus efficace.
4. Donner l'expression du quotient de la réaction Qr.
Qr = [lactate d'éthyle] / ([éthanol] [ acide lactique ] ).
5.
Le lactate d'thyle est plus soluble dans le solvant introduit dans le
procédé b que dans la phase de départ ( acide lactique + éthanol ).
Justifier que l'ajout d'un solvant lors de cette synthèse permet de
déplacer l'équilibre de cette réaction.
En ajoutant un solvant dans lequel l'ester est très soluble, on
l'élimine de la phase de départ au fur et à mesure de sa
formation.
L'équilibre est donc déplacé dans le sens direct, formation de l'ester.
6. 28
millions de tonnes de solvants organiques sont produits chaque année.
Evaluer le volume d'éthanol nécessaire à la substitution de 80 % en
masse des solvants organiques par des solvants agrosourcés.
On fait l'hypothèse que la totalité du solvant agrosourcé produit est
du lactate d'éthyle obtenu par le procédé b. Comparer cette valeur au
volume d'éthanol produit annuellement dans le monde : 120 milliards de
litres.
Quantité de matière d'éthanol pour obtenir une mole de lactate d'éthyle soit 118 g : n = 1 mol.
28 millions de tonnes = 28 1012 g.
28 1012 *0,80 =2,24 1013 g.
Quantité de matière de lactate déthyle : 2,24 1013 / 118=1,90 1011 mol.
Quantité de matière correspondante d'éthanol : 1,90 1011 mol.
Tenir compte du rendement du procédé b : 1,90 1011 / 0,80 = 2,37 1011mol.
Masse d'éthanol : 2,37 1011 x 46,0 =1,09 1013 g.
Masse volumique d'éthanol : 0,789 g / mL.
Volume d'éthanol : 1,09 1013 / 0,789 =1,38 1013 mL.
soit 1,38 1010 L ou 13,8 milliards de litres.
13,8 / 120 ~0,12 ( 12 %) de la production annuelle mondiale.
|
|








