Acide
base, oxydo-réduction, dosage par étalonnage : une boisson de
réhydratation
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
Objectif : vérifier la teneur en glucose de la boisson.
1. Etude de la liqueur de Fehling.
On prépare une solution de liqueur de Fehling en mélangeant :
- une solution aqueuse A contenant des ions Cu2+aq ;
- une solution aqueuse B obtenue lors du mélange d'une solution d'acide tartrique H2T aq et d'une solution de soude. Le pH de la solution B est égal à 12.
1.1- Ecrire la formule semi-développée de l'acide tartrique et entourer les groupes caractéristiques.
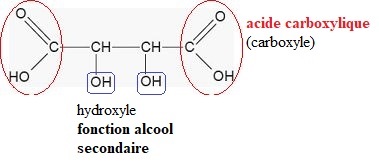
1.2. Déterminer la forme prédominante dans la solution B parmi les espèces H2T, HT- et T2-.
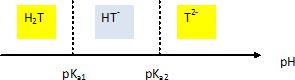
pKa1 = 3,5 ; pKa2 = 4,2.
A pH =12, T2-aq prédomine.
1.3- En déduire l'équation de la réaction chimique modélisant la transformation ayant lieu lors de la préparation de la solution B.
H2T aq + 2HO- aq --> T2-aq + 2H2O(l).
Lors du mélange des solutions A et B, les ions Cu2+aq réagissent avec les ions tatrate T2-aq pour former des ions CuT22-aq, seuls responsables de la coloration bleue.
1.4- En déduire l'équation de la réaction chimique modélisant la transformation ayant lieu lors du mélange des solutions.
Cu2+aq +2T2-aq -->CuT22-aq.
On donne le spectre d'absorption de la liqueur de Fehling.
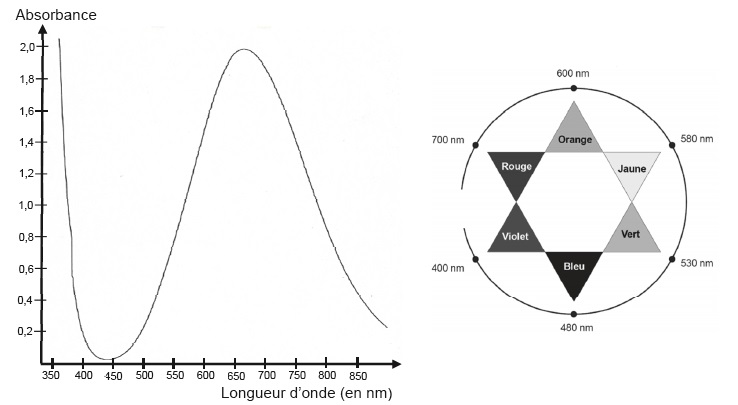
1.5. Justifier la couleur de la solution de la liqueur de Fehling.
Cette liqueur présente un maximum d'absorption vers 650 nm ( rouge
orange). La solution possède la couleur complémentaire du rouge orange,
c'est à dire bleu vert.
Dosage par étalonnage du glucose.
le glucose réagit avec les ions CuT22-. Cette transformation chimique est totale et donne l'ion gluconate et l'oxyde de cuivre Cu2O(s) de couleur rouge brique.
2CuT22- +C5H11-CHO aq + 5HO-aq --> Cu2O(s) +C5H11-COO- aq + 4T2-aq + 3H2O(l).
2.1. Justifier le catactère réducteur du glucose à l'aide d'une demi-équation électronique.
C5H11-CHO aq + 3HO-aq -->C5H11-COO- aq + 2e- ++ 2H2O(l).
Le glucose est un réducteur ; il s'oxyde et libère des électrons.
2.2. A l'issue de
la réaction entre une solution étalon de glucose et la solution
de liqueur de Fehling, le filtrat est de couleur bleue. Identifier le
réactif limitant.
La couleur bleue est due à la liqueur de Fehling en excès ; le glucose est le réactif limitant.
2.3 Proposer une longueur d'onde optimale pour régler le spectrophotomètre afin de réaliser les mesures.
Pour un maximum de précision, on choisit une longueur d'onde pour
laquelle la liqueur de Fehling présennte un maximum d'absorption, soit
environ 650 nm.
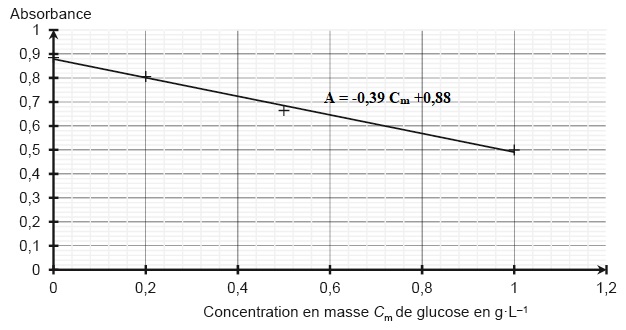
2.4. Expliquer pourquoi l'absorbance du filtrat diminue lorsque la concentration en masse du glucose augmente.
L'absorbance est proportionnelle à la concentration résiduelle de liqueur de Fehling.
Lorsque la concentration en masse du glucose augmente, la liqueur de Felhing est en moindre excès.
|
Afin
de déterminer la masse de glucose contenue dans un sachet de
médicament permettant la réhydratation, on réalise l'expérience
suivante :
- une solution S1 de volume V1 = 500,0 mL est préparée en dissolvant le contenu du sachet dans l'eau distillée ;
- cette solution est diluée d'un facteur 10 pour obtenir la solution S2.
- en réalisant le même protocole que pour les solutions étalons, on
mesure une absorbance A = 0,59 lorsqu'on utilise 10,0 mL de solution S2 à la place de 10 mL de solution étalon.
2.5. Déterminer la masse de glucose contenue dans le sachet de médicament et commenter.
0,59 = -0,39 Cm +0,88 ; Cm = (0,88-0,59) / 0,39 =0,7436 g / L.
Prendre en compte la dilution : 0,7436 x10 ~7,4 g / L.
Soit environ 3,7 g d glucose dans la solution S1, c'est à dire dans un sachet.
Le fabricant indique 4,0 g de glucose.
Ecart relatif : (4-3,7) / 4 =0,075 ( 7,5 %).
|
|



