Titrage
acide-base : un indicateur coloré issu du chou rouge.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
1. Modèlisation d'un indicateur coloré naturel issu du chou rouge.
la
couleur du chou rouge est due à la présence d'une vingtaine
d'anthocyanes différentes. On modèlise ce mélange complexe d'espèces
chimiques par une seule espèce chimique, la cyanidine dont la structure
est commune à toutes les anthocyanes.
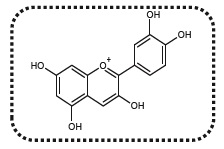
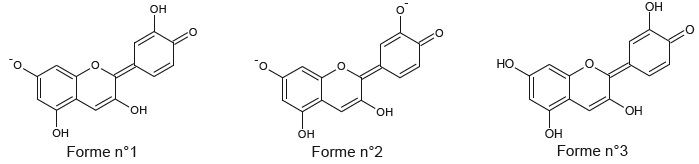
On limite la modèlisation à des pH compris entre 4,5 et 9,0. La cyanidine existe principalement sous trois formes.
On prépare une solution de chou rouge en faisant macérer pendant 10
minutes dans de l'eau distillée chaude le quart d'un chou rouge coupé
en morceaux. On foltre le mélange et on obtient une solution aqueuse de
couleur violet bleu intense. On fait varier le pH de la solution et on
note la couleur correspondante.
1.1- Justifier que la forme 1 est amphotère.
La forme 1 est susceptible de céder un proton pour donner la forme 2 : elle se comporte en acide.
La forme 1 est susceptible de gagner un proton pour donner la forme 3 : elle se comporte en base.
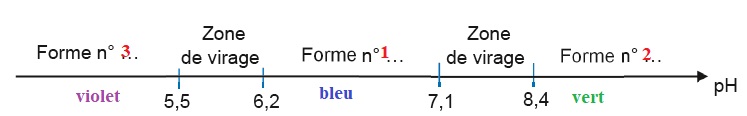
1.2. Compléter le diagramme de prédominance ci-dessous. Associer une couleur à chaque forme en solution aqueuse.
Titrage d'un lait fermenté.
Des
bactéries transforment le lactose du lait frais en acide lactique.
L'acidité Dornic d'un lait doit être supérieure à 80°D pour pouvoir
fabriquer un yaourt.
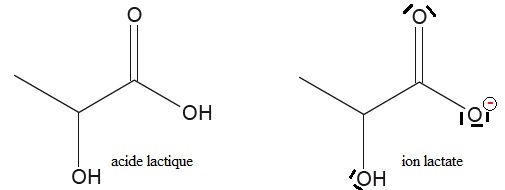
2.1. Représenter le schéma de Lewis de l'ion lactate.
2.2.
Justifier que la fermentation du lait contribue à acidifier celui-ci..
La
fermentation du lait transforme le lactose en acide lactique ; la
présence de cet acide contribue à augmenter l'acidité du lait.
2.3. On veut modéliser la transformation chimique entre l'acide lactique est l'eau. On note AH l'acide lactique et A-
l'ion lactate. Ecrire l'équation de cette réaction. Montrer que cette
transformation chimique est spontanée. On admettra que la concentration
initiale en ion lactate est nulle.
AH aq + H2O = A-aq + H3O+aq. Ka = 10-3,9.
Quotient de réaction initial Qr i =[ H3O+aq]i[A-aq]i / [AH aq]i = 0.
Qr i < Ka, la réaction évolue dans le sens direct jusqu'à atteindre l'équilibre.
|
La méthode Dornic consiste à titrer 10,0 mL de lait par une solution aqueuse d'hydroxyde de sodium de concentration C0 =0,111 mol / L.
AH aq + HO-aq --> A-aq + H2O(l).
On
utilise le chou rouge comme indicateur coloré. Le pH initial vaut 5,9
et le pH à l'équivalence vaut 8,3. Le volume versé à l'équivalence est Véq = 2,8 mL.
2.4 Justifier l'utilisation du chou rouge comme indicateur coloré. Préciser le changement de couleur.
Le pH du point d'équivalence appartient à la zone de virage [7,1 ; 8,4] de l'indicateur coloré. Le chou rouge convient.
La solution passe du bleu au vert à l'équivalence.
2.5. Déterminer si l'acidité Dornic du lait fermenté convient pour la fabrication d'un yaourt.
Quantité de matière d'acide lactique à l'équivalence : n = C0 Véq = 0,111 x 2,8 = 0,3108 mmol dans 10,0 mL de lait.
Concentration en acide lactique : 0,3108 / 10,0 = 0,03108 mol/ L.
M( AH) =90,1 g / mol.
Concentration massique correspondante : 0,03108 x90,1 =2,80 g / L.
1,0°D correspond à une concentration en masse d'acide lactique égale à 0,10 g / L.
Soit 2,8 / 0,1 = 28 °D, valeur inférieure à 80°D. Ce lait ne convient pas.
|
|