Additif
alimentaire pour les agnaux. Bac Amérique du
Nord 2021.
Conductimétrie, programme en langage Python.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts..
..
|
|
..
..
......
...
|
L'ajout
quotidien de chlorure d'ammonium à l'alimentation des agnaux, à raison
d'environ 300 mg ( à 10 % près) par kg de masse corporelle, est une
solution efficace pour prévenir la maladie appelée gravelle. Le
chlorure d'ammonium est un acide qui permet d'abaisser le pH des urines.
Un éleveur administre chaque jour, à un agnau de 24 kg, un litre d'une solution de chlorure d'ammonium qu'il a préparé lui-même.
On souhaite vérifier que cette préparation est conforme à la préconisation.
A. Réalisation du titrage.
On réalise le titrage conductimétrique d'un volume VA = 10,00 mL de la solution préparée par l'éleveur, diluée avec Veau = 200 mL d'eau distillée, par une solution titrante d'hydroxyde de sodium de concentration CB = (0,100 ±0,002) mol / L.
Equation de la réaction : NH4+aq + HO-aq --> NH3aq + H2O(l).
A.1. S'agit-il d'une réaction acido-basique ou d'une réaction d'oxydoréduction ? Justifier.
Réaction acido-basique : l'acide NH4+aq transfert un proton H+ à la base HO-aq.
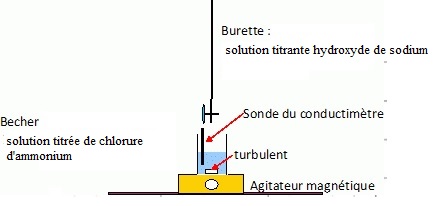
A.2. Réaliser un schéma légendé du dispositif de titrage.
.
On obtient la courbe suivante :
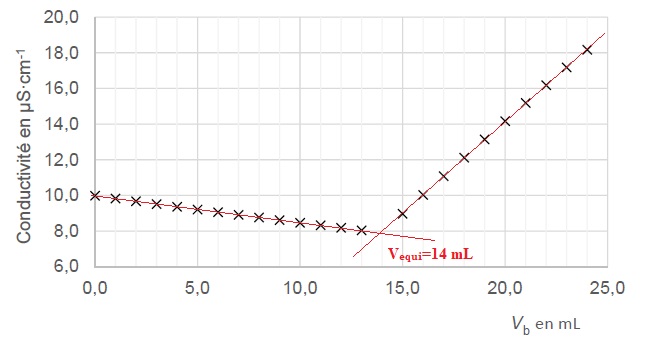
A.3. Exprimer en fonction des données la concentration CA en quantité de matière de chlorure d'ammonium apporté puis calculer sa valeur.
A l'équivalence CB Véqui = CA VA ;
CA =CB Véqui / VA = 0,100 x 14,0 / 10,0=0,140 mol / L.
L'incertitude type sur la valeur de la concentration obtenue satisfait à la relation :
U(CA) = CA [(U(CB) / CB)2 +(U(Véqui) / Véqui)2 +(U(VA) / VA)2 ]½.
Incertitude sur la verrerie : burette de 25 mL : ±0,05 mL ; pipette jaugée de 10 mL : ±0,02 mL.
A.4. Proposer un encadrement de la concentration CA.
U(CA) = 0,14 [(0,002 / 0,100)2 +(0,05 / 14)2 +(0,02 / 10)2 ]½.
U(CA) = 0,14 [(0,0004 +1,3 10-5 +4 10-6 ]½= 0,14 x2,0 10-2 =2,9 10-3 ~3 10-3.
0,140 -3 10-3 < CA < 0,140 +-3 10-3 ;
0,137 < CA <0,143 mol / L.
A.5. La masse de chlorure d'ammonium est-elle correcte ?
M(NH4Cl) =53,5 g / mol.
0,137 x53,5 < Cmassique <0,143 x53,5 g / L.
7,3 < Cmassique < 7,7 g / L.
7,3 / 24< Masse / kg < 7,7 / 24 g / kg.
0,30 < Masse / kg < 0,32 g / kg.
300 < Masse / kg < 320 mg / kg.
La préparation de l'éleveur est correcte.
|
....
|
Simulation du titrage.
Pour simuler l'évolution des quantités de matière des 5 espèces présentes en solution lors du titrage : NH4+, HO-, Cl-, Na+ et NH3, on utilise un programme en langage python.
Les quantités de matière sont notées nA, nB, nC, nS_A et nS_B.
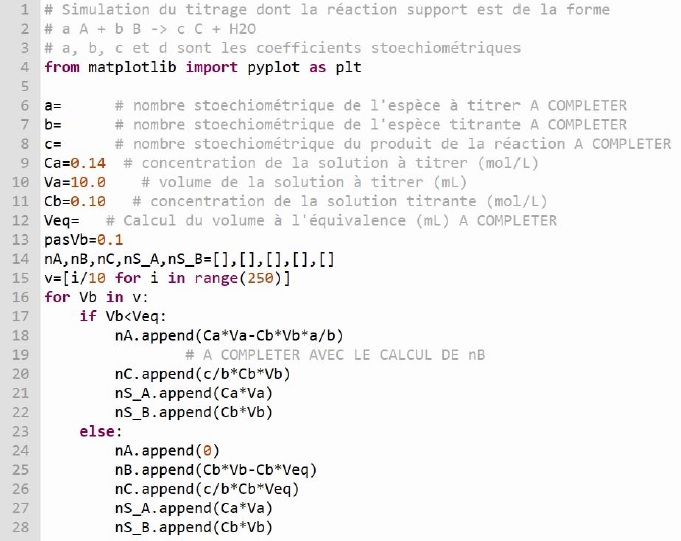
1. Compléter le code aux lignes 6, 7 et 8.
Ligne 6 : a = 1.
Ligne 7 : b = 1
Ligne 7 : c = 1
2. Identifier les deux espèces chimiques qui correspondent aux variables nS_A et nS_B.
Ion chlorure Cl- et ion sodium Na+.
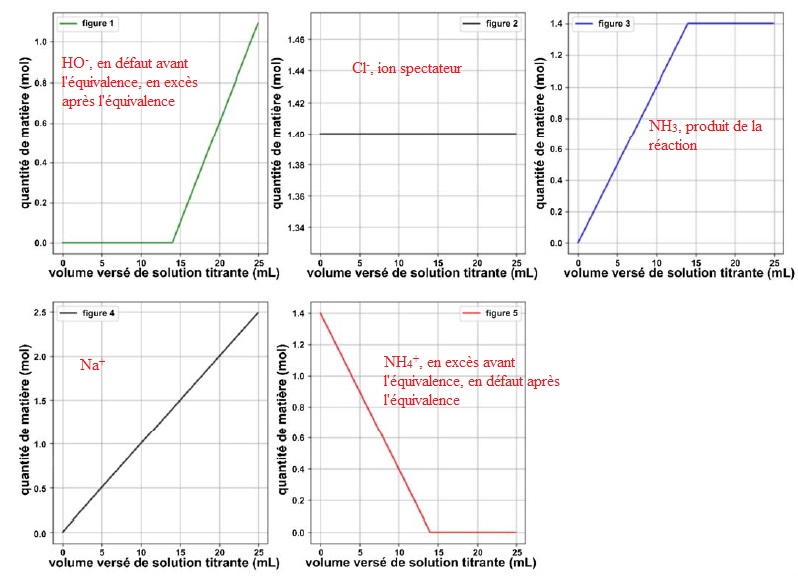
Chacun des 5 graphiques suivants, obtenus à l'aide du programme en
langage python représente l'évolution de la quantité de matière d'une
des espèces chimiques en fonction du volume versé de solution titrante.
3. Indiquer pour chaque graphe l'espèce chimique correspondante.
Remarque : les quantités de matière doivent être en mmol et non pas en mol.
4. Compléter le code des lignes 12 et 19.
Ligne 12 : Veq=Ca*Va/Cb
Ligne 19 : nB.append(0*0)
|
|



