Etude
d'un produit dopant, le salbutamol,
Capes physique chimie 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
L’absorption
de substances chimiques visant à augmenter les performances physiques
des sportifs constitue une pratique illégale : le dopage. Le salbutamol
est un bronchodilatateur (permet la dilatation des bronches et des
bronchioles), utilisé dans le traitement de l’asthme et connu en France
sous le nom commercial de Ventoline®. Mis sur le marché dans les années
1960, il est l’un des produits dopants les plus utilisés.
1) Étude de la molécule de salbutamol.
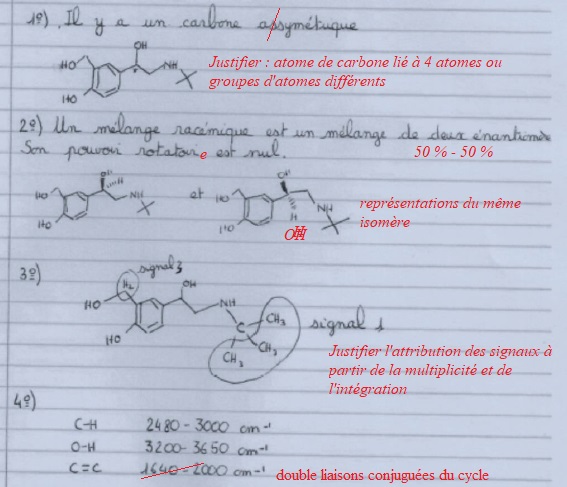
Q22. Une étude
structurale et spectroscopique du salbutamol a été proposée à des
élèves de terminale STL suivant la spécialité SPCL. Sur le
document-réponse de l’Annexe 5 est proposée la reproduction d’une copie
d’élève. Corriger la copie de l’élève en repérant les erreurs, en
annotant la copie et en formulant les conseils appropriés.
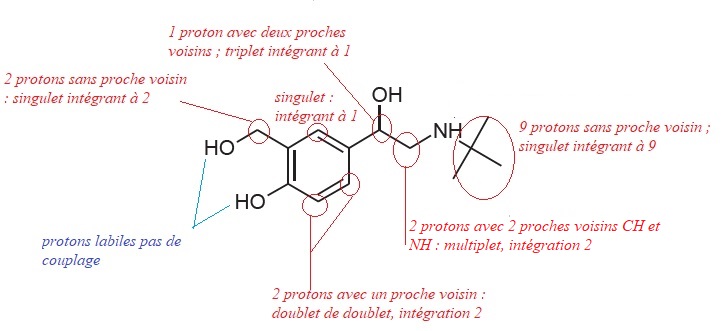
Q23. Réaliser
l’attribution des signaux RMN notés 1, 3 et 4 en justifiant la
multiplicité spectrale et l’intégration des signaux observés. Attribuer
le signal RMN noté 2 et préciser, en justifiant, la multiplicité
spectrale de ce signal noté 2.
Q24. Un
professeur affecté dans un établissement proposant une section de
formation de techniciens supérieurs « Métiers de la Chimie » est en
charge d’une classe dont environ un tiers des élèves poursuit ses
études au sein de cette formation chaque année. Proposer des pistes de
différenciation de l’activité présentée dans l’Annexe 4, sachant que
deux groupes d’élèves ont été constitués :
un groupe composé d’élèves souhaitant s’orienter vers un BTS métier de la chimie, un IUT de chimie, une classe préparatoire ;
un groupe d’élèves souhaitant s’orienter vers des études sans lien avec la chimie.
Pour le premier groupe d'élèves :
Questions proposées :
Représenter les 2 énantiomères du salbutanol et donner leur configuration absolue.
Les spectres RMN et IR proposés sont-ils en accord avec la structure du salbutanol ?
2) Synthèse du salbutamol.
La première synthèse du salbutamol sous forme d’un mélange racémique à
partir du 2- hydroxybenzoate de méthyle a été présentée par D.T.
Collins en 1970. Le schéma réactionnel des premières étapes de la
synthèse est présenté.
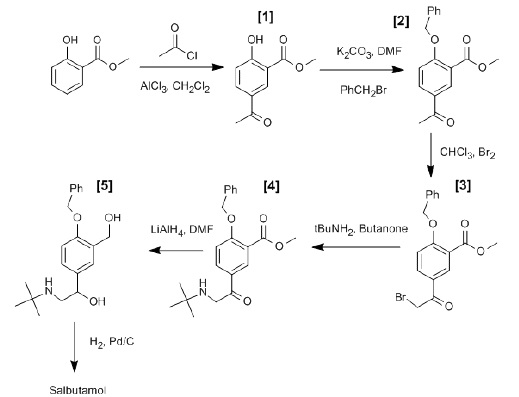
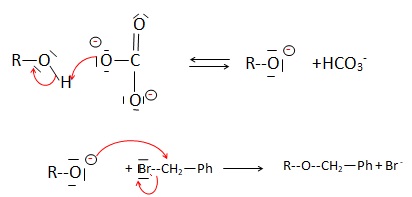
Q25. Donner le
mécanisme réactionnel associé au passage de l’intermédiaire [1] à
l’intermédiaire [2]. Préciser l’intérêt de cette étape de synthèse.
Protection du groupe hydroxyle.
Q26. Indiquer la nature de la transformation associée au passage de [3]
à [4] d’une part, et de [4] à [5] d’autre part. Pour cela, choisir pour
chaque transformation, en justifiant, un ou plusieurs termes dans la
liste suivante : réaction acide-base, réaction de complexation,
réaction d’oxydo-réduction, addition nucléophile, addition
électrophile, substitution nucléophile, substitution électrophile.
[3]
à [4] : substitution nucléophile de Br par (CH3)3NH2.
[4] à [5] : oxydo-réduction, réduction d'une cétone en alcool.
|
|
....
|
3) Dosage du salbutamol.
Le dosage spectrophotométrique par étalonnage du salbutamol issu de
préparations pharmaceutiques est réalisé en le transformant en dimère
sous l’action d’une solution d’ion permanganate impliqué dans le couple
MnO4−(aq)/ MnO4 2−(aq). Le couple d’oxydoréduction
entre le salbutamol et son dimère est le suivant : C26H40N2O6(aq)/C13H21NO3(aq).
Protocole expérimental du dosage du salbutamol.
a. Extraction du
salbutamol d’un comprimé Le comprimé de Ventoline® est dissous dans 4
mL d’une solution d’hydroxyde d’ammonium et le salbutamol subit une
triple extraction par 5 mL de chloroforme. La phase organique est
ensuite séchée et passée à l’évaporateur rotatif. Le résidu est ensuite
dissous dans un volume minimal d’une solution d’acide sulfurique
faiblement concentrée, puis dilué avec de l’eau distillée dans une
fiole de 100,0 mL.
b. Gamme d’étalonnage Dans une fiole jaugée de 10,0 mL on introduit successivement :
un volume V d’une solution de sulfate de salbutamol à 5,00x10-5 mol.L-1,
1,00 mL d’une solution d’hydroxyde de sodium à 0,50 mol.L-1,
2,60 mL d’une solution de permanganate de potassium fraichement préparée à la concentration 5,00 10-3 mol.L-1.
La fiole est ensuite complétée avec de l’eau distillée jusqu’au trait
de jauge et laissée au repos pendant 30 minutes. À l’issue de ce délai,
l’absorbance de la solution est mesurée pour une longueur d’onde de 610
nm. Dans ces conditions, il est possible de considérer que seule
l’espèce MnO42−(aq), ion produit par la réaction, absorbe le rayonnement. Les résultats expérimentaux sont reportés dans le tableau ci-dessous
c. Etude de l’échantillon inconnu Dans une fiole jaugée de 10,0 mL on introduit successivement :
1,00 mL de la solution de sulfate de salbutamol préparée à partir du comprimé à tester,
1,00 mL d’une solution d’hydroxyde de sodium à 0,50 mol.L-1,
2,60 mL d’une solution de permanganate de potassium fraichement préparée à la concentration 5,00.10-3 mol.L-1.
Comme pour la gamme d’étalonnage, la fiole est ensuite complétée avec
de l’eau distillée jusqu’au trait de jauge et laissée au repos pendant
30 minutes. À l’issue de ce délai, l’absorbance de la solution est
mesurée pour une longueur d’onde de 610 nm. La mesure de l’absorbance
de la solution issue de l’extraction est de : A = 0,3291.
V(mL)
|
1,20
|
3,60
|
4,80
|
5,00
|
5,40
|
5,70
|
6,00
|
Absorbance
|
0,1647
|
0,4899
|
0,6489
|
0,6881
|
0,7460
|
0,7889
|
0,8226
|
Q27. Attribuer les domaines du diagramme E-pH du manganèse.
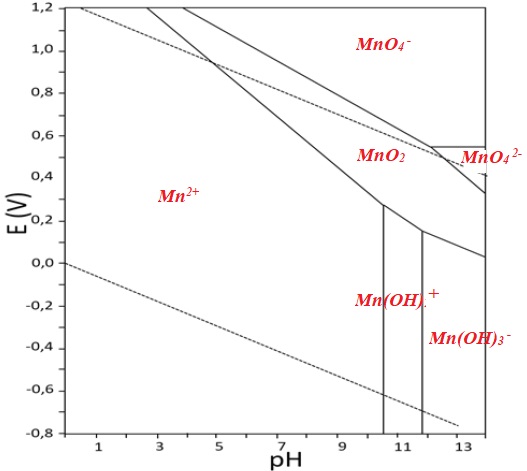
Q28. En utilisant
le diagramme E-pH , indiquer la raison pour laquelle la solution de
permanganate de potassium doit être préparée fraichement avant
utilisation.
Les ions permanganate oxydent lentement l'eau en dioxygène.
Q29. Écrire l’équation
bilan de la réaction modélisant la transformation chimique se
produisant dans la fiole jaugée lorsqu’on introduit le salbutamol et
les ions permanganate en milieu basique.
2 C13H21NO3(aq)+ 2MnO4- aq+ 2HO-aq---> C26H40N2O6(aq) + 2MnO4 2−(aq) +2H2O(l).
Q30.
Résolution de problème. La posologie efficace habituelle en sulfate de
salbutamol indiquée sur la notice est de 16 mg/jour. Déterminer le
nombre journalier de comprimés à administrer afin de respecter cette
posologie.
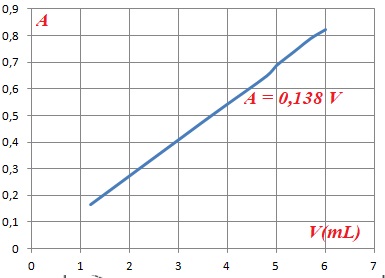
V = 0,3291 / 0,138 =2,38 mL.
Quantité de matière correspondante n = c V =5,00 10-5 x 2,38 10-3=1,19 10-7 mol dans 1 mL.
Soit 1,19 10-5 dans 100 mL ou dans un comprimé.
Masse correspondante m = n M(salbutamol) = 1,19 10-5 x 336,4 =0,0040 g = 4,0 mg.
Il faut prendre 4 comprimés par jour.
|
|