Physique
chimie, mécanisme réactionnel de l'hydrolyse basique d'un ester
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
En
1934, M.Polanyi et A. Szabo cherchent à déterminer le mécanisme
réactionnel le plus plausible lors de l'hydrolyse basique d'un ester.
Protocole expérimental.
L'éthanoate de pentyle est synthétisé en laboratoire puis mis en réaction avec de l’hydroxyde de sodium enrichie en isotope 18O. Pour obtenir ce dernier réactif, de l’eau enrichie en isotope 18O est fournie par le Professeur G. Hertz de Berlin : dans certaines molécules d’eau, l’isotope naturel le plus abondant (16O) est remplacé par un isotope « lourd » de l’oxygène : 18O.
La densité de l’eau enrichie est égale à 1,00033 par rapport à de l’eau
ordinaire prise à la même température ce qui représente un écart de
densité de 330 ppm (parties par million). Du sodium métallique est
ainsi mis en présence de l’eau enrichie en 18O, conduisant à la formation de soude enrichie selon la réaction d’équation : Na(s) + H2O(l) = Na+(aq) + HO–(aq) + ½ H2(g)
La solution d’hydroxyde de sodium ainsi obtenue est alors mise en
présence d’éthanoate de pentyle. Le mélange est chauffé à 70 °C pendant
2 jours. Des tests ont montré qu’avec ce traitement l’hydrolyse était
complète.
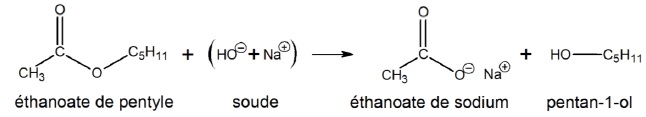
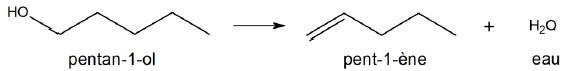
L’alcool obtenu est isolé, puis déshydraté par passage à travers de la
bauxite à 400 °C. Cette réaction produit du pent-1-ène et de l’eau :
L’eau produite est isolée et purifiée, et sa densité est mesurée à
l’aide d’un micropycnomètre construit par M. Polanyi et E.S. Gilfillan.
Plusieurs hydrolyses sont effectuées. Certaines, réalisées avec de
l’eau ordinaire, servent de témoin. La précision du micropycnomètre est
estimée par ses constructeurs à : ± 5 ppm.
Numéro et date de l'expérience
|
Eau utilisée
|
Écart de densité de l’eau obtenue lors de la déshydratation de l’alcool, par rapport à l’eau ordinaire (en ppm)
|
1. 19 /3 - 24 /3 /1934
|
ordinaire
|
-3
|
| 2. 24 /3 - 29 /3 /1934 |
enrichie
|
+1
|
| 3. 6 / 4 - 12 / 4 /1934 |
enrichie
|
+2
|
| 4. 7 /4 - 13 / 4 /1934 |
ordinaire
|
-6
|
| 5. 13 /4 - 18 /4 /1934 |
enrichie
|
+13
|
1. Définir la notion d’isotopie.
Deux atomes istopes ne diffèrent que par leur nombre de neutrons. Ils ont le même numéro atomique Z.
2. Écrire l’équation d’une réaction permettant de synthétiser l’éthanoate de pentyle.
CH3-COOH + CH3-CH2-CH2-CH2-CH2-OH = CH3-COO-CH2-CH2-CH2-CH2-CH3 + H2O.
acide éthanoïque + pentan-1-ol = éthanoate de pentyle + eau
La bauxite contient une forte teneur en alumine Al2O3. Elle intervient comme un acide de Lewis et peut être modélisée dans les mécanismes réactionnels par l’ion H+.
3. Écrire le mécanisme réactionnel de la déshydratation d'un alcool en milieu acide.
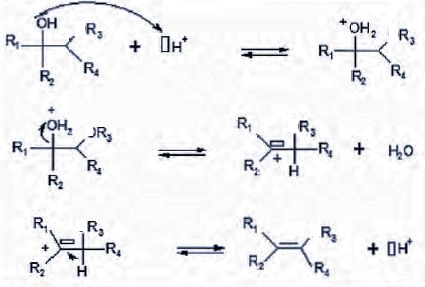
On souhaite déterminer
lequel des deux mécanismes ci-dessous permet d’interpréter le mieux la
réaction d’hydrolyse basique de l’éthanoate de pentyle.
4. Recopier les deux mécanismes ci-dessus et pour chacun :
compléter le mécanisme avec le minimum de flèches courbes ;
indiquer la nature de chaque étape réactionnelle parmi les propositions suivantes :
addition, élimination, substitution ou réaction acide-base.
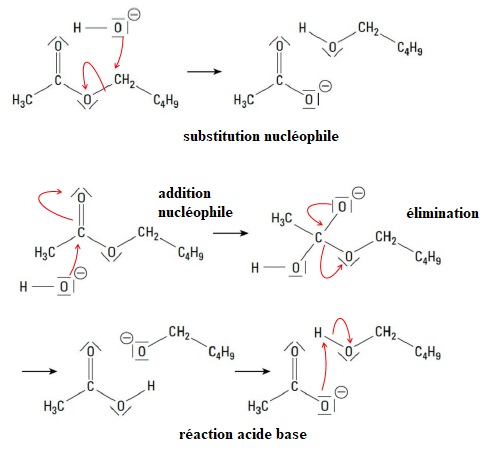
5. Déterminer, en justifiant, quel mécanisme est validé par l’étude de Polanyi et Szabó ?
Dans le premier mécanisme, 18O se retrouve dans l'alcool. La déshydratation de ce dernier donnerait de l'eau marquée à 18O et en conséquence à un écart de densité de l'ordre de 300 ppm. Mais les mesures ne le confirment pas.
Ce mécanisme n'est donc pas à retenir.
Dans le second mécanisme, 18O se retrouve dans l'ion éthanoate. Ce mécanisme est validé.
Une revue bibliographique permet de repérer d’autres faits expérimentaux :
des études cinétiques montrent que la réaction d’hydrolyse basique
des esters a un ordre global égal à 2 (ordres partiels : 1 pour l’ester
et 1 pour l’ion hydroxyde) ;
des études stéréochimiques montrent que la réaction d’hydrolyse basique d’esters possédant un atome de
carbone asymétrique directement lié à l’atome d’oxygène se fait sans inversion de configuration.
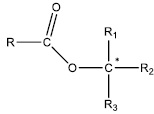
6. Déterminer si
les études cinétiques et les études stéréochimiques valident ou
invalident le mécanisme proposé à l’issue de l’étude de Polanyi et
Szabó.
Les deux mécanismes étant d'ordre 2, létude cinétique ne permet pas de conclure.
Dans le mécanisme 1, l'atome de carbone asymétrique change de configuration.
Dans le mécanisme 2, l'atome de carbone asymétrique n'est pas concerné et ne change pas de configuration.
Le mécanisme 2 est donc validé.
|




