Physique
chimie, l'huile de lin, concours général 2020.
Synchrotron Soleil  Jouer du violon. Jouer du violon.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
16. Justifier l'emploi d'huile de lin dans ma majorité des vernis à l'huile utilisés par les luthiers.
Chaque luthier cherche :
à garantir au violon une protection durable,
à lui donner un bel aspect brillant,
à préserver sa sonorité sur le long terme.
2.1. Détermination de l'indice d'iode théorique de l'huile de lin.
17. Déterminer la quantité de matière de chacun des acides gras insaturés présents dans l'huile de lin.
Composition massique d'un flacon de 100 mL en acide gras.
acide linolénique C18H30O2
M =278 g / mol
|
acide linoléique C18H32O2
M =280 g / mol
|
acide oléique C18H34O2
M =280 g / mol
|
acides saturés
|
53 %
|
13%
|
22 %
|
12 %
|
93 x0,53 /278=0,177 mol
|
93 x0,13 /280=0,043 mol |
93 x0,22 /282=0,073 mol |
|
Masse volumique à 20 °C : 0,93 g / mL.
18. Ecrire l'équation de la réaction du diiode sur une double liaison < C = C <.
< C = C < + I2 ---> 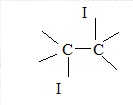
19. En déduire l'indice d'iode théorique de cette huile.
L'indice d'iode est la masse de diiode I2 ( M = 254 g / mol) capable de sa fixer sur 100 g de corps gras.
Dans 100 g de corps gras : .
|
acide linolénique C18H30O2
M =278 g / mol
|
acide linoléique C18H32O2
M =280 g / mol
|
acide oléique C18H34O2
M =280 g / mol
|
Quantité de matière (mol)
|
0,177 *100 / 93 =0,19
|
0,043 *100 / 93 =0,0462
|
0,073 *100 / 93 =0,0785
|
Nombre de double liaison C=C
|
3
|
2 |
1 |
Masse de diiode (g)
|
3 x0,19 *254 ~145
|
2x0,0462 x254 =23,5
|
0,0785x254=19,9
|
Indice d'iode :145 +23,5 +19,9 ~188.
2.2 Détermination expérimentale de l'indice d'iode de l'huile de lin.
Etape 1 : le chlorure d'iode ICl est ajouté en excès à une masse ce corps gras connue avec précision.
R-CH=CH-R' + ICl --> R-CH Cl -- CH I - R'.
Etape 2. L'excès de chlorure d'iode est transformé en diiode par ajout d'iodure de potassium en excès.
Etape 3. On titre le diiode formé lors de l'étape 2 par une solution de thiosulfate de sodium de concentration C = 0,20 mol / L..
2.3 a propos de l'étape 1.
20. Ecrire l'équation de la réaction entre le chlorure d'iode est l'acide linoléique.
C18H30O2 +2ICl --> C18H30O2 I2Cl2.
21. A quelle type de réaction appartient cette réaction ?
Réaction d'addition sur une double liaison C=C.
22. Cette étape pourrait-elle être facilement mise en oeuvre dans un laboratoire de lycée ?
Non, cette étape met en oeuvre du chloroforme ou du trichlorométhane, substances dangereuse par ingestion et inhalation.
23. Expliquer le rôle de chacun des deux erlenmeyers dans cette méthode.
L'un des erlenmeyer contient le chlorure d'iode et l'huile de lin. L'ensemble des trois étapes se déroule dans ce dernier.
L'autre ne contient pas de liaison C=C, mais le chlorure d'iode. On
détermine ainsi la quantité de matière initiale de chlorure d'iode.
2.4. A propos de l'étape 2.
24. Déterminer l'équation de la réaction modélisant la seconde étape.
ICl excès +KI ---> I2 + KCl.
ou bien ICl + I-aq --> I2aq + Cl-aq.
25. Proposer une explication quant aux 5 minutes d'agitation avant le titrage.
La réaction entre le chlorure d'iode et l'ion iodure est sans doute
lente. L'agitation permet la transformation totale du chlorure d'iode
excédentaire en diiode.
2.5. A propos de l'étape 3.
26. Les couples oxydant / réducteur mis en jeu sont I2aq / I-aq et S4O62-aq / S2O32- aq.
En déduire l'équation de la réaction support du titrage.
Oxydation : 2S2O32- aq --> S4O62-aq +2e-.
Réduction : I2 aq + 2e- --> 2I-aq.
Bilan : 2S2O32- aq + I2 aq --> S4O62-aq +2I-aq.
27. Soient n(I2)A et n(I2)B,
les quantités de matière de diiode se trouvant dans les deux
erlenmeyers A et B à l'issue de la seconde étape, avant titrage.
Exprimer chacune d'entre elles en fonction de C Véq A ou Véq b.
n(I2)A = 0,5 C Véq A. n(I2)B = 0,5 C Véq B.
28. En déduire l'expression des quantités de matière restantes nrestant (ICl) dans les erlenmeyer à l'issue de l'étape 1.
nrestant (ICl) A = n(I2)A = 0,5 C Véq A.
nrestant (ICl) B = n(I2)A = 0,5 C Véq B.
29. En déduire
l'expression de la quantité de matière de chlorure d'iode ayant réagi
au cours de l'étape 1 avec les double liaisons des acides gras présents
dans l'huile de lin.
nréagi (ICl) = n(I2)A = 0,5 C (Véq B - Véq A).
30. En déduire la valeur de l'indice diode expérimental de cette huile de lin. Commenter.
Véq B = 22,40 mL ; Véq A= 4,00 mL ; C = 0,20 mol/ L
nréagi (ICl) =0,10* ( 22,4 -4,00) 10-3 =1,84 10-3 mol.
Le chlorure d'iode se comporte comme le diiode.
n(I2) =1,84 10-3 mol.
Masse de diiode :1,84 10-3 *254 =0,467 g.
Masse d'huile de lin mesurée : m = 0,252 g.
Indice d'iode de cette huile : 0,467 / 0,252 * 100~185.
Ce résultat est cohérent avec celui de la question 19.
|
...
|
....
|
2.6 Polymérisation du vernis.
La standolisation est une polymérisation thermique de l'huile à haute température ( 270°C) en absence de dioxygène.
Son mécanisme est décrit ci-après.
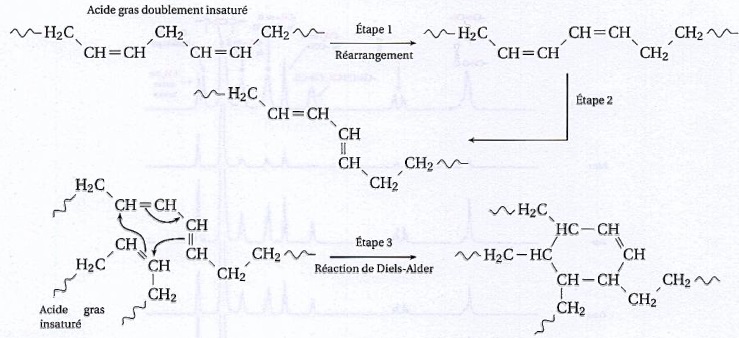
31. Décrire les évolutions des acides gras au cours des étapes 1 et 2 du mécanisme.
Etape 1 : réarrangement de la chaine carbonée, déplacement des doubles liaisons C=C.
Etape 2 : isomérisation, passage de l'isomère Z à l'isomère E.
32. Que représentent les flèches courbes dans l'étape 3 ?
Les flèches courbes représentent les déplacements des doublets d'électrons.
33. Pourquoi la standolie de lin est-elle plus visqueuse que l'huile de lin ?
La présence d'un cycle dans la standolie de lin ( encombrement plus
important), se traduit pas une gène supplémentaire entre les molécules.
En conséquence la viscosité va croître.
On donne les spectres RMN de différentes huiles.
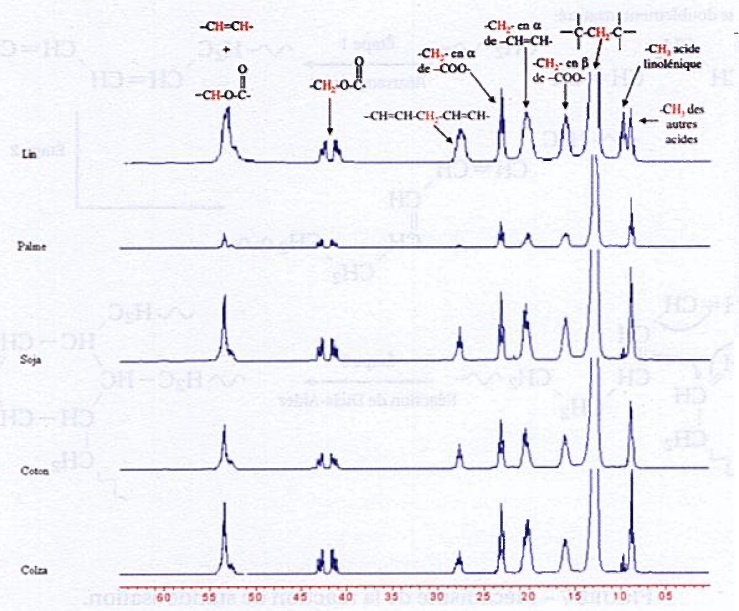
34. Justifier que le pic de référence soit un doublet de hauteur constante.
Le pic de référence correspond aux hydrogènes des groupes CH2 du glycérol.
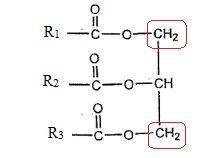
Le carbone voisin des ces groupes porte un seul atome d'hydrogène : le signal RMN de ces CH2 est donc un doublet.
Ces groupes n'apprtiennent pas aux chaînes d'acides gras ;ils ne sont
pas modifiés lors de la standolisation. D'où un signal de hauteur
constante.
35. Justifier le choix de l'huile de lin pour fabriquer des standolies.
L'huile de lin est à forte teneur en acide gras doublement insaturé. La standolisation sera rapide.
36. Interpréter le comportement de l'huile de palme lors de la standolisation.
L'acide gras doit
être doublement insaturé. L'huile de palme contient peu d'acide gras
doublement insaturé. La standolisation de cette huile est par
conséquent lente.
37. Discuter du choix des conditions expérimentales.
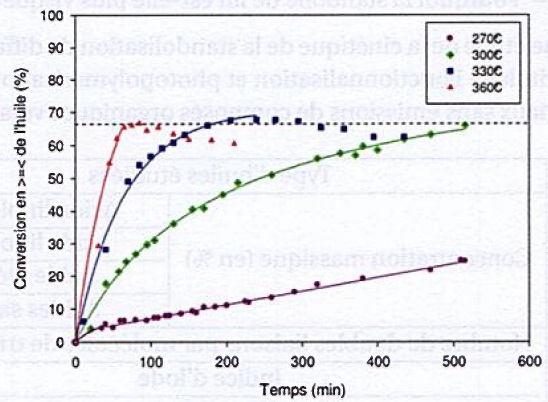
A 500 minutes :
A 330° et à 360°C ll standolisation est totale.
On dépense plus d'énergie à 360° C qu'à 330 °C.
La perte de produit est plus faible à 330°C qu'à 360°C.
On choisit donc une température de 330°C.
|
|

 Jouer du violon.
Jouer du violon.



