Techniques
d'analyses, concours 2019 d'accès au Doctorat LMD.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
......
.....
|
Chimie organique.
Exercice 1.
( 4 points ).
Une solution aqueuse de permanganate ( c = 1,28 10-4 mol / L) a une absorbance A = 0,30 à 525 nm, si on utilise une cuve de 0,1 dm de parcours optique.
a. Calculer le coefficient d'absorption molaire du permanganate pour cette longueur d'onde.
La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme :
A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1.
e (L mol-1 cm-1) est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe.
l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
e = A / (l c) =0,30 /(1 *1,28 10-4) =2,34 103 L mol-1 cm-1.
b. Si on double la concentration, calculer l'absorbance et la transmittance de la nouvelle solution.
A = 2 *0,30 = 0,60 ;transmittance T : A = -log (T) ; T = 10-A =10-0,6 =0,25.
Exercice 2. 4 points.
Un composé organique de formule brute C3H6O2 :
L'analyse RMN 1H donne les déplacements suivants : 1 triplet
à 1,5 ppm ( 3 protons), un quadruplet à 4,2 ppm ( 2 ptotons), un
singulet à 8 ppm ( 1 proton).
L'analyse IR donne les pics suivants pics vers 3000 cm-1, 1700 cm-1, 1200 cm-1.
Trouver la formule développée de ce composé.
1 triplet à 1,5 ppm ( 3 protons), un quadruplet à 4,2 ppm ( 2 ptotons) : CH3-CH2.
un singulet à 8 ppm ( 1 proton) : -OH d'un acide carboxylique.
1700 cm-1 : groupe C=O.
3000 cm-1 O-H.
1200 cm-1 C-O.
CH3-CH2-COOH.
Exercice 3.
5 points.
Un liquide organique incolore de masse molaire 101 g / mol, d'odeur
désagréable, soluble dans les solutions acides aqueuses ne possède pas
de bande IR dans la région 3300- 3500 cm-1.
L'analyse centésimale donne : % C = 71,23 ; %H =14,85 ; %N = 13,87.
L'analyse RMN 1H donne :1 triplet vers 1 ppm ; un quadruplet vers 2,5 ppm.
Donner la formule développée de ce composé.
CxHyNz.
M = 12 x +y+14z = 101.
12 x / 71,23 = y / 14,85 = 14z / 13,87 = 101 /100 = 1,01.
x = 1,01 *71,23 / 12 ~6.
y = 1,01 *14,85 ~15.
z = 1,01 *13,87 / 14 ~1.
C6H15N.
Pas de bande IR dans la région 3300- 3500 cm-1: pas de liaison N-H.
1 triplet vers 1 ppm ; un quadruplet vers 2,5 ppm : CH3-CH2.
(CH3-CH2)3 N.
Exercice 4. 7 points.
D'après les spectres, donner la structure du composé de formule moléculaire C10H13NO2. Justifier en indiquant sur les spectres l'attribution des signaux RMN et d'absorption IR caractéristiques.
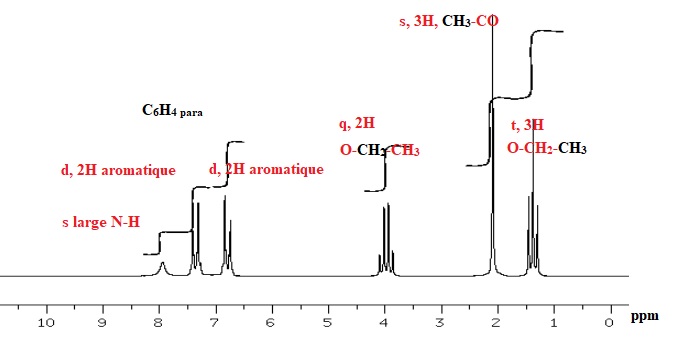
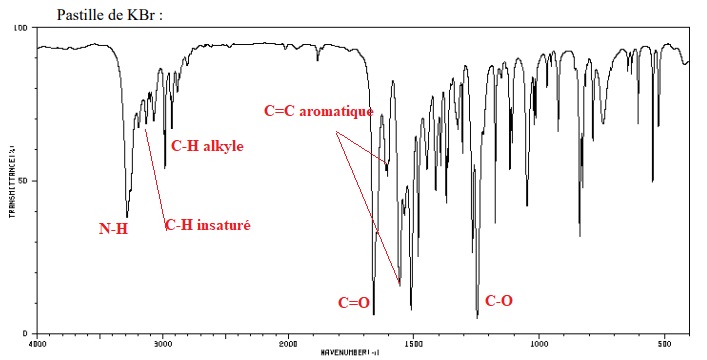
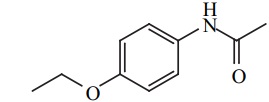
|
...
|
|
|
....
|
Chimie inorganique.
Exercice 1. ( 5
points)
L'eau
solide présente plusieurs variétés allotropiques. Les atomes d'oxygène
forment une structure de type diamant. Les atomes d'hydrogène
s'alignent entre les atomes d'oxygène les plus proches. La distance d1
la plus courte entre un atome d'oxygène et un atome d'hydrogène est 100
pm. On note d2 la distance la plus longue. Le paramètre de maille, noté
a, vaut 637 pm.
1. Représenter la maille de la glace III, variété stable pour des pressions supérieure à 3 103 bar.
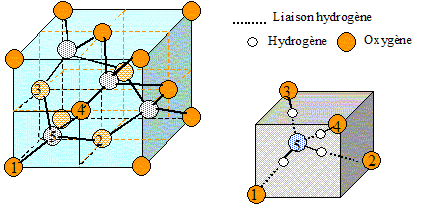
Exercice 2. 7 points
1. Dans le cadre de quelles approximations construit-on un diagramme d'Ellingham ?
L'entropie DrS° et l'enthalpie DrH° étant supposées indépendantes de la température, les courbes d'équation DrG°(T) = DrH° - T DrS° sont des segments de droites. Les ruptures de pente correspondent à des changements d'états physiques.
2. Construire le diagramme d'Ellingham du zinc pour 273 K < T < 1773 K. On établira les équations.
Zn(s) + 0,5 O2(g) = ZnO(s).
DrG°1 ( J mol-1) = -348,3 103 +100,5 T.
T fusion (Zn) =693 K ; Dfusion H°(Zn) = 6,7 kJ /mol ; Tvaporisation (Zn) = 1180 K
Dvaporisation H°(Zn) = 114,8 kJ /mol ;Tfusion (ZnO) = 2248 K.
Pour T < 693 K : DrG°1 ( J mol-1) = -348,3 103 +100,5 T (droite 1).
Pour 693 < T <1180 K : Zn(l) +½O2(g) = ZnO (s).
DrH°2=DrH°1-DfusionH°zinc=-348,3 -6,7 = -355,0 kJ mol-1.
DrS°2=DrS°1-DfusionH°zinc/ Tfusion=-100,5 -6,7103 / 693 = -110,2 J K-1 mol-1.
DrG°2 ( J mol-1) = -355 103 +110,2 T. ( droite 2).
Pour 1180 < T <1773 K : Zn(g) +½O2(g) = ZnO (s).
DrH°3=DrH°2-DvaporisationH°zinc=-355 -114,8 = -469,8 kJ mol-1.
DrS°3=DrS°2-DvaporisationH°zinc/ Tvaporisation=-110,2 -114,8103 / 1180 = -207,5 J K-1 mol-1.
DrG°3 ( J mol-1) = -469,8 103 +207,5 T. ( droite 3).
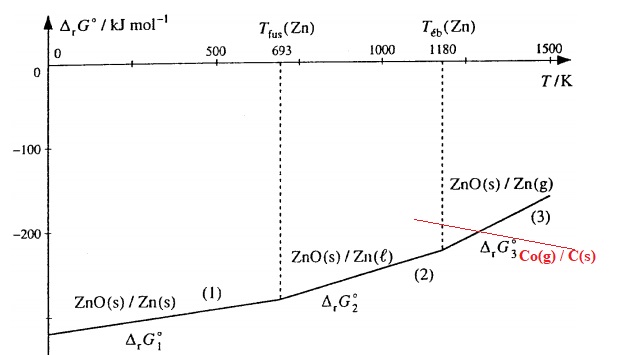
Pour le couple CO/C, l'équation de réaction est : C(s) +½O2(g) = CO(g).
DrG°(J /mol) =-110,5 103 -89,5 T.
3. Ecrire l'équation de la réaction de réduction de ZnO par le carbone.
ZnO(s) + C(s) = CO(g) + Zn(g).
4. Déterminer la
température d'inversion de cette réaction. Dans quel domaine de
température la réaction sera t-elle favorisée ? ( constante d'équilibre
> 1).
A l'intersection des deux droites :
-469,8 103 +207,5 T =-110,5 103 -89,5 T.
T = 358,5 103 / 297 = 1207 K.
ZnO peut être réduit par le carbone à une température supérieure à 1207 K.
Exercice 3. 8 points.
Les alliages 1 % d'arsenic, 99 % plomb sont utilisés pour
fabriquer des plomb de chasse. La figure suivante représente le
diagramme isobare d'équilibre solide / liquide de ce mélange
binaire.
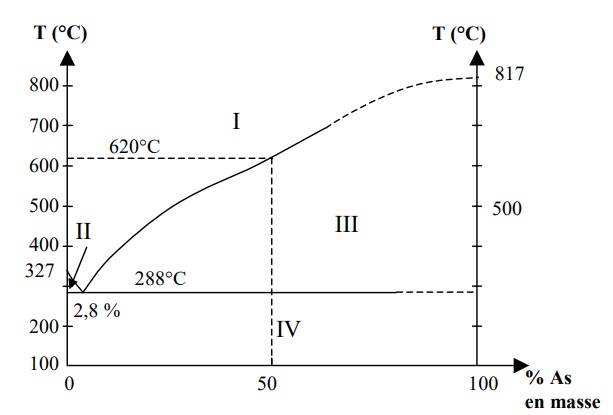
a. Indiquer l'état physique et la nature des phases présentes dans chaque domaine.
Domaine I : liquide avec As et Pb.
Domaine II : liquide avec As et Pb et Pb solide.
Domaine III : liquide avec As et Pb et As solide.
Domaine IV : deux phases solides avec As et Pb.
b. Ces alliages sont-ils homogènes ou hétérogènes ?
Dans le domaine IV il existe deux phases solides : les alliages arsenic plomb sont hétérogènes.
c. Comment nomme t-on l'alliage contenant 2,8 % d'arsenic en masse ? Quelle est sa particularité ?
L'eutectique : ce mélange se solidifie à une température bien définie.
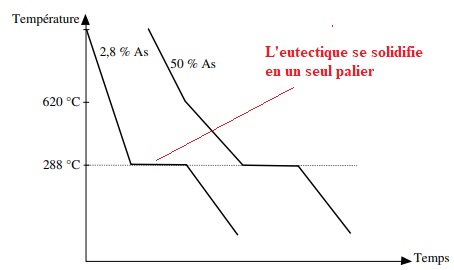
d. Tracer
schématiquement les courbes de refroidissement correspondant à 2
mélanges liquide contenant respectivement 2,8 et 50 % en masse
d'arsenic.
|
|






