Physique
chimie, concours technicien ministère de l'économie et des finances
2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
1. Arome
de vanille.
La synthsèse de la vanilline se fait en
trois étapes :
Etape 1 : - synthése de l'acétate d'isoeugénol à
partir de
l'isoeugénol
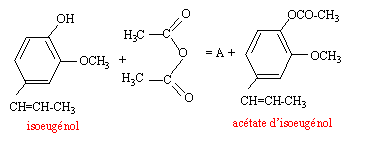
Etape 2 : transformation de
l'acétate d'isoeugénol en acétate
de vanilline.
Etape 3 :
action de l'eau sur l'acétate de vanilline
|
espéce chimique
|
masse molaire g/mol
|
quelques propriétés
|
|
isoeugénol
|
164
|
d=1,08
nocif en cas d'ingestion, irritant pour les yeux, la
peau, les voies respiratoires
|
|
acétate d'isoeugénol
|
205
|
Tfusion = 80°C
solubles dans la plupart des solvants organiques,
insoluble dans l'eau glacée
|
|
anhydride éthanoïque
|
102
|
d=1,08
corrosif, inflammable, provoque des brûlures
réagit avec l'eau
|
A
synthèse de l'acétate d'isoeugénol
: mode opératoire.
- Dans un ballon de 250 mL,
introduire 10 g d'isoeugénol, 20
mL d'anhydride acétique, quelques gouutes d'acide orthophosphorique.
- Chauffer en utilisant un chauffage à reflux et maintenir une
ébullition douce pendant 30 minutes.
- refroidir jusqu'à température ambiante. verser le contenu du
ballon dans un becher contenant 30 mL d'eau glacée, tout en agitant.
- Filtrer sur büchner et laver les cristaux formés avec de
l'eau glacée.
1. Quel est le
rôle du montage à reflux ?
Le montage à reflux permet de travailler à température
modérée ( la vitesse de la réaction augmente) tout en évitant les
pertes de matière ( les vapeurs se condensent dans le réfrigérant
vertical et retombent dans le ballon).
2 et 3. Quelles
précautions faut-il prendre pour manipuler
l'anhydride éthanoïque ?
- Pourquoi utilise-t-on de l'anhydride éthanoïque à la place de l'acide
éthanoïque ?
Travailler sous hotte avec de la verrerie sèche, mettre des
gants et des lunettes.
L'anhydride éthanoïque conduit à une réaction totale alors que
l'acide éthanoïque conduit à un réaction limitée par l'hydrolyse de
l'ester.
4. L'acide orthophosporique est un
catalyseur de la synthèse.
Quel est son rôle ?
Le catalyseur augmente la vitesse de la réaction en remplaçant
une réaction lente par deux réactions rapides. Le catalyseur est
régénéré en fin de réaction.
5. Quelle est la formule
semi-développée et le nom de l'espèce
A ? A : acide éthanoïque
CH3-COOH.
6. Pourquoi verse-t-on le contenu du
ballon dans l'eau glacée ?
Dans l'eau glacée l'acétate d'isoeugénol est insoluble : des
cristaux se forment.
7 et 8. Calculer la
quantité de matière initiale de chacun des
réactifs. L'expérimentateur a obtenu 11,3 g de cristaux d'acétate
d'isoeugénol. Calculer le rendement de la synthèse.
isoeugénol : masse (g)
/ masse molaire (g/mol) = 10 / 164 =
0,061 mol
anhydride éthanoïque :
masse (g) = volume (mL) fois densité=
20*1,08 = 21,6 g
21,6 / 102 = 0,212 mol
(en excès)
Qté de matière d'ester
prévue : 0,061 mol soit 0,061*205 =
12,5 g
rendement : mase
expérimentale / masse théorique = 11,3 / 12,5
= 0,904 ( 90,4
%).
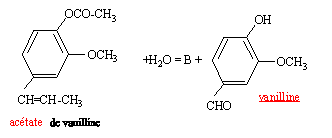
Synthèse
de la vanilline :
9. Quelle est la formule
semi-développée et le nom de l'espèce
B ?
Acide
éthanoïque CH3-COOH.
10. Quel est le nom
donné à cette réaction ?
Hydrolyse d'un ester.
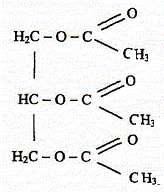
2. Techniques séparatives.
11. Déterminer la formule
semi-développée du triacétate de glycéryle.
12. Expliquer le
principe de la chromatographie. Que signifie le terme phase gazeuse ?
Couplage
chromatographie en phase gazeuse et spectrométrie de masse.
La chromatographie est une méthode de
séparation et d'identification des constituants d'un mélange.
La
chromatographie est basée sur la différence de solubilité d'une
substance dans deux phases non miscibles : la phase stationnaire liée
au support et la phase mobile ou solvant.
Plus
une substance est soluble dans la phase mobile, plus elle est entraînée
par cette phase; inversement, une substance peu soluble dans la phase
mobile migre peu.
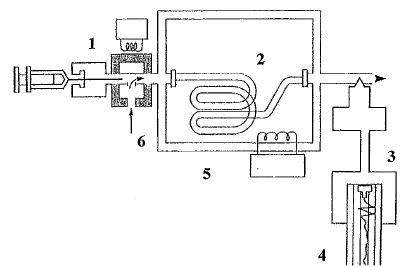
1 : injecteur
; 2 : colonne ; 3 : détecteur ; 4 : intégrateur ou
ordinateur ; 5 : thermostat de colonne ; 6 : gaz vecteur.
La chromatographie permet de séparer les espèces d'un mélange complexe
de nature diverses.
Elle
est utilisée pour repérer les substances qui composent un mélange gazeux ou
susceptibles de le devenir sans décomposition par chauffage.
13.
Quel rôle joue le spectromètre de masse ? Quel type d'ionisation est la
plus fréquente dans ce type de couplage ? Expliquer le principe de ce
type d'ioniseur.
La
spectrométrie de masse consiste à vaporiser une espèce ( dont la
molécule est notée M), puis à l'ioniser ( une ou plusieurs fois). Les
ions obtenus sont ensuite accélérés par un champ électrique. Les ions
peuvent rester inchangés ou se scinder en fragments plus petits ( eux
même chargés ou non ). Un dispositif, appelé analyseur, sépare les
différents ions suivant leur rapport masse sur charge m/q où m est la
masse de l'ion et q sa charge. les ions sont récuérés dans les
récepteurs qui génèrent un courant dont l'intensité est proportionnelle
aux nombres des ions détectés.
Electrospray
: dispersion d’un liquide sous forme de gouttelettes chargées
électriquement.
Les
goutellettes formées à l'extrémité d'un capillaire sont
soumises à un champ électrique intense.
14. Suite à un
changement de colonne, le temps de rétention de la molécule a changé
malgré des conditions d'analyse identique ( même débit et même rampe de
température ) Cependant nous savons que le pic de la triacétine devrait
être élué à un temps de rétention entre 10,00 et 13,50 minutes. 4 pics
présents sur le chromatogramme peuvent correspondre.
Pic
|
temps
de rétention (minute)
|
largeur
du pic à la base (min)
|
facteur
de rétention
|
sélectivité
|
solvant
|
1,08
|
|
|
|
A
|
10,23
|
0,17
|
(10,23-1,08)
/ 1,08 =8,47
|
|
B
|
10,99
|
0,22
|
(10,99-1,08)
/ 1,08=9,18
|
|
C
|
12.85
|
0,33
|
(12,85-1,08)
/ 1,08=10,90
|
|
D
|
13,47
|
0,35
|
(13,47-1,08)
/ 1,08 =11,47
|
|
Quels
facteurs peuvent avoir influencé le changement de temps de rétention ?
Déterminez les facteurs de rétention ( ou de capacité) de ces 4 pics.
Déterminer également les facteurs de séparation ( ou sélectivité) ainsi
que la résolution entre tous les pics consécutifs ( A-B, B-C, C-D).
Le temps de rétention varie en fonction du débit, de la
température d'élution, de la composition de la phase mobile et du
vieillissement de la colonne.
Facteur de rétention = rapport du temps passé par le soluté dans la
phase stationnaire sur le temps passé par ce même soluté dans la
phase mobile.
k =(tri-tm) / tm.
La sélectivité mesure l'aptitude de la colonne à séparer le composé i
du composé j : a
= kj / ki.
aA-B
=9,18 / 8,47=1,08 ; aB-C =10,9 /
9,18=1,19 ; aC-D =11,47 /
10,9=1,05.
Résolution
R =2(tRi-tRj) / (somme des bases des pics).
RA-B =2(10,99-10,23) / (0,22+0,17)=3,9.
RB-C
=2(12,85-10,99) / (0,22+0,33)=6,76.
RC-D
=2(13,47-12,85) / (0,35+0,33)=1,8.
15. Quelle valeur
est prioritairement utilisée pour juger de la bonne séparation des pics
? Pourquoi ? Sont-ils bien séparés dans ce cas ?
Pour les valeurs de R > 1,5, les pics sont bien séparés. Ils sont
bien séparés dans ce cas.
16. Les 4 pics
présentent les spectres de masse suivants. Un spectre
pourrait-il correspondre à la triacétine ? Justifier.
L'allégation "sans arôme ajouté " écrite sur l'emballage est-elle
valable ?
Les spectres présentent tous un pic important à m/z = 43 ([CH3CO]+).
Ils pourraient correspondre à la triacétine.
L'allégation "sans arôme ajouté " écrite sur l'emballage n'est
pas
valable.
17. On remarque que les pics
s'élargissent avec le temps. Expliquer la
raison de cet élargissement. Par quelle relation peut-on théoriser cela
? Expliquer les termes de cette équation.
La vitesse de progression des solutés n'est pas tout à fait
identique ( ils prennent des chemins différents dans la phase
mobile). Les pics s'élargissent avec le temps de rétention.
Equation de Van Ddemter :H = A + B / U + C U.
U : vitesse de la phase mobile.
H : hauteur équivalente d'un plateau théorique ( efficacité).
B / U traduit la dispersion du soluté.
C U : résistance au transfert du soluté entre les phases mobile et
stationnaire.
3. Calculs de pH.
18. Calculer la
concentration en ion H3O+ en moles / litre des
solutions aqueuses présentant les pH suivants :
pH = 4,10 ; [
H3O+]
= 10-4,10 =7,94 10-5 mol /L.
pH
= 1,25 ; [
H3O+]
= 10-1,25 =0,056 mol /L.
pH
= 7,00 ; [
H3O+]
= 10-7 mol /L.
19. Déterminer le
pH d'une solution d'acide iodique HIO3 à 5 10-3
mol / L. Ka(HIO3 /IO3-) =
0,16.
Ka = [IO3-]
[H3O+]
/ [HIO3]
=x2 /(C-x) avec x avancement volumique.
x2
=0,16(C-x) ; x2+0,16 x -0,16 x5 10-3 = 0.
x2+0,16 x -0,0008 = 0.
Discriminant D
=0,162 +4x0,0008 =0,0288= 0,172.
x =(-0,16 +0,17) / 2 =0,00485 ~0,0049 mol / L.
pH = - log(0,0049) =2,3.
20. Quelles sont
les concentrations de H3O+, CH3COOH et
CH3COO- dans une solution d'acide acétique de
pH=4 ? Donner la concentration initiale C0 de CH3COOH
avant équilibre.
Ka = 1,8 10-5.
[H3O+]
= [CH3COO-
] = 10-4 mol / L.
Ka
= [H3O+]
[
[CH3COO-
] /
[CH3COOH
].
[CH3COOH
] =
[H3O+]
[
[CH3COO-
] / Ka = 10-8 / (1,8
10-5
) =5,56 10-4 mol / L.
C0 = [CH3COO-
]+
[CH3COOH
]=6,56
10-4 mol / L.
|
...
|
....
|
4. Oxydo-réduction, alcool dans le sang.
A 1 mL de sang est ajouté 10 mL de dichromate de potassium à 7 g / L.(M
= 294 g / mol).
L'excès de dichromate est réduit par l'iodure de potassium.
Cette solution est dosée par le thiosulfate de sodium à 0,05 mol/L. VE
= 15 mL.
21. Donner les
demi-équations des couples suivants : Cr2O72-
/ Cr3+ et RCOOH / alcool ; I2/I- et S4O62-
/ S2O32-.
22. Donner les
équations des réactions mises en jeu.
23.
Calculer le taux d'alcool dans le sang en g / L et conclure.
3 fois { C2H5OH +H2O = CH3COOH + 4H+ +
4e- } oxydation alcool.
2 fois { Cr2O72- + 14H+ + 6e- =
2Cr3+ +
7 H2O } réduction
de l'ion dichromate.
3C2H5OH + 2Cr2O72- +16H+= 3CH3COOH
+ 4Cr3+ +
11 H2O (1)
Cr2O72- +
6 e- +14
H+ =
2 Cr3+ +
7 H2O.
3 fois{2I- =
I2 +2e-}.
Cr2O72- +
6 I- +14
H+ =
2 Cr3+ +3I2 +7
H2O.
n (I2)=3
n(Cr2O72-)excès.
I2 +2e-=
2I-.
2S2O32- =
S4O62- +
2e-.
I2 +2S2O32- =
S4O62- +2I-.
n(I2)
=½n(S2O32-).
Par suite : 3 n(Cr2O72-)excès =½n(S2O32-)
;
n(Cr2O72-)excès =n(S2O32-)
/ 6.
n(Cr2O72-)initial
=7 / 294 x10 / 1000 = 2,38 10-4 mol.
n(Cr2O72-)excès =n(S2O32-)
/ 6 =0,05 x15 10-3 / 6 =1,25 10-4 mol.
n(Cr2O72-)
oxydant l'alcool
=(2,38-1,25) 10-4 =1,13
10-4 mol.
n(alcool) = 1,5 x1,13
10-4 =1,695
10-4 mol.
M(alcool) = 46 g / mol.
Masse d'alcool : 46 x1,695 10-4 =7,8 10-3 g dans
1 mL soit 7,8 g / L, valeur largement supérieure à 0,5 g / L. Il y a
infraction.
5.
Validation de méthode.
24. Expliquer
l'intérêt d'une validation de méthode.
Cette validation permet d'assurer la fiabilité et la traçabilité des
résultats d'une analyse en laboratoire à partir d'une matrice donnée.
25. Expliquer le
sens de la répétabilité et de la reproductibilité.
Répétabilité : les valeurs obtenues en suivant une même procédure (
même méthode, même instrument, même opérateur) subissent de faibles
variations.
Reproductibilité : Les valeurs obtenues en faisant varier les
conditions de mesure ( méthode, instrument, opérateur ) subissent de faibles variations.
26. Qu'est qu'une
méthode juste et fidèle ?
Juste : l'écart entre le résultat d'une mesure et la valeur vraie de la
grandeur mesurée est faible.
Fidèle : étroitesse
de l'accord entre les mesures effectuées sur des prises multiples d'un
échantillon homogène.
6. Permanganate de
potassium.
On dispose d'une poudre de parmanganate de potassium pure à 98,3
% et on souhaite faire 200 mL de solution à 0,5 mol / L. Deux solutions
filles diluées à 0,1 et 0,05 mol/L seront préparées.
27. Calculez les
quantités nécessaires à la préparation de la solution mère et proposez
un protocole pour la préparation de ces trois solutions.
Quantité de matière : n = C V = 0,5 x0,2=0,1 mol.
M(KMnO4) =158 g / mol ; masse m = 158 x0,1 = 15,8 g de
produit pur.
Masse à peser : 15,8 / 0,983 =16,07 g.
Peser 16,07 g de solide ( balance de précision + coupelle).
Verser dans une fiole jaugée de 200 mL contenant 1 / 3 d'eau distillée
et surmontée d'un entonnoir à solide.
Rincer coupelle et entonnoir.
Agiter jusqu'à dissolution complète puis compléter jusqu'au trait de
jauge avec de l'eau distillée. Agiter pour rendre homogène.
Solution fille à 0,1 mol / L : fiole jaugée de 200 mL ; pipette jaugée
de 200 / 5 = 40 mL.
Solution
fille à 0,05 mol / L : fiole jaugée de 200 mL ; pipette jaugée de 200 /
10 = 20 mL.
Prélever la solution mère ; verser dans la fiole jaugée ; complèter
jusqu'au trait de jauge avec de l'eau distillée ; agiter.
28. Que signifient les
pictogrammes suivants ?

29. Quelles
précautions faut-il prendre pour le stockage de ce produit ?
Récipient bien fermé, au sec, endroit frais et ventilé.
Ne pas stocker près de matières combustibles.
7. Réfraction de la lumière.
30.
Une radiation lumineuse se propageant dans l'air pénètre dans un
liquide sous une incidence i= 40°. L'angle de réfraction est r = 30°.
Déterminer l'indice du liquide.
1 sin i = n sin r ; n = sin 40 / sin 30 =1,29.
31. Soient les dioptres suivants dont les milieux ont pour indices
respectifs :
n1 = 1,644 ; n2 = 1,502.
n1 = 1,644 ; n2 = 1,000.
n1 = 2,420 ; n2 = 1,000.
Déterminer pour chacun d'eux la valeur de l'angle d'incidence
limite.
n1 sin ilim = n2 sin 90 ; sin ilim = n2
/ n1.
sin ilim =1,502 / 1,644 =0,9136 ; ilim
=66,0° ;
sin ilim =1,000 / 1,644 =0,6083 ; ilim
=37,46° ;
sin ilim =1,000 / 1,420 =0,413 ; ilim
=24,41°.
8. Effet Doppler.
Un radar de contrôle routier émet une onde sonore continue qui se
réfléchit sur une cible. La figure ci-dessous représente le front
d'onde à l'instant t = 4 T ( T : période temporelle ).
A. Véhicule muni d'une
sirène et immobile.
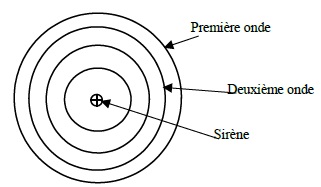
Fréquence du son f = 680 Hz ; vson = 340 m /s
32. Définir une
onde sonore mécanique progressive.
Propagation d'une perturbation ( variation de pression) dans un milieu
matériel avec transport d'énergie, sans transport de matière.
33. Expliquer le
principe de propagation d'une onde sonore. Précisez en justifiant sa
nature longitudinale ou transversale.
La variation de pression se propage dans le milieu matériel. L'onde est
longitudinale.
34. Définissez la
période temporelle et précisez sa valeur.
Durée séparant deux perturbations identiques en un point donné.
T = 1 / f = 1 / 680 =1,47 10-3 s .
35. Définissez la
période spatiale et précisez sa valeur.
Plus petite distance séparant deux points dans le même état vibratoire.
l = vson
T = vson / f = 340 / 680 = 0,50 m.
36. Déterminez si
deux points situés à la distance d = 55,0 m l'un de l'autre dans la
même direction de propagation sont en phase. Justifier.
55 = 110 x0,5 = 110 l.
Deux points distants d'un nombre entier de longueur d'onde vibrent en
phase.
37. Déterminez la
distance parcourue par le front d'onde à t = 3T.
d = vson x 3T = 340 x3 x1,47 10-3 =1,50 m.
38. L'onde se
réfléchit sur un obstacle situé à 680 m de la source. Déterminer le
temps au bout duquel l'écho de l'onde revient à la source après
émission du signal.
t = distance aller + retour / célérité = 2 x 680 / 340 = 4 s.
B. Le véhicule se déplace
à la vitesse v.
39. Expliquer le
principe de l'effet Doppler.
Le
radar émet une onde continue qui est réfléchie par toute cible se
trouvant dans la direction pointée. Par effet Doppler, cette onde
réfléchie possède une fréquence légèrement différente de celle émise :
plus grande fréquence pour les véhicules s'approchant du radar et plus
petite pour ceux s'en éloignant.
40.
Le véhicule se rapproche d'un observateur immobile. Donnez la relation
entre f ', fréquence perçue par l'observateur, f fréquence de la
sirène, v et vson.
f ' = f / (1-v / vson).
41. Le son perçu
par l'observateur fixe possède une fréquence f ' = 716 Hz. Le son
est-il plus grave ou plus aigu que le son d'origine ? Justifier.
f ' > f, le son perçu est plus aigu.
42. Déterminer la
vitesse v du véhicule.
1-v / vson = f / f '.
v / vson = 1-f / f ' ; v = vson(1-f
/ f ') =340 (1-680 / 716) =17,1 m /s ( 61,5 km / h).
|
|





