Physique
chimie, l'éthylamine C2H7N, concours Geipi polytech 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
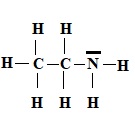
1. Représenter le schéma de Lewis de l'éthylamine.
En solution dans l'eau, l"éthylamine se comporte comme une base faible de pKa = 10,7.
2. Compléter le diagramme de prédominance.
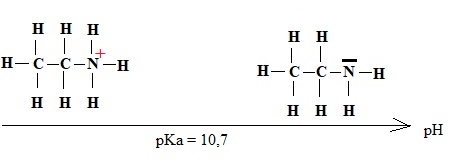
3. Ecrire l'équation de la réaction de l'éthylamine sur l'eau.
C2H7N + H2O = C2H8N+ +HO-.
4. Donner l'expression littérale de la constante d'équilibre puis la calculer.
C2H8N+ + H2O = C2H7N + H3O+ ;
Ka = [ C2H7N] x[H3O+ ] / [ C2H8N+ ]
K = [ C2H8N+ ] [HO- ] / [ C2H7N] = [ C2H8N+ ] / ( [ C2H7N] x[H3O+ ]) x [HO- ][H3O+ ].
K = Ke / Ka =10-14 / 10-10,7=10-3,3 =5,0 10-4.
On se propose de doser un résidu industriel considéré comme une
solution aqueuse d'éthylamine par une solution d'acide chlorhydrique de
concentration Ca = 0,10 mol / L.
La réaction peut s'écrire sous une forme simplifiée :
B + H3O+ --> BH+ +H2O avec B = éthylamine.
La réaction est considérée comme totale.
Le pH de l'échantillon est de 11,6 au départ ; on en prélève V = 25,0
mL que l'on amène par addition d'eau à 50 mL pour effectuer le dosage.
5. Déterminer le pH de la solution titrante d'acide chlorhydrique.
pH = - log (Ca) = -log(0,10) = 1.
Le dosage est suivi par pHmétrie.
6. Déterminer graphiquement le volume équivalent.
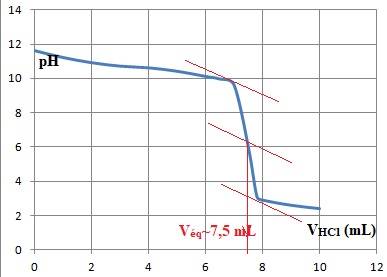
7. En déduire la concentration molaire puis la concentration massique de l'éthylamine dans ce résidu.
A léquivalence : Ca Véq = C V ; C = Ca Véq / v =0,10 x7,5 / 25 =0,030 mol / L.
M(éthylamine) = 2 x12 +7 +14=45 mol/ L.
Concentration massique : 0,030 x 45 = 1,35 g / L.
|