Questions préliminaires.
Condition A : conservation à basse température (5°C) et à l’abri de la lumière.
Condition B : conservation à température ambiante (25°C) et à l’abri de la lumière.
Condition C : conservation à température ambiante (25°C) et exposée à la lumière.
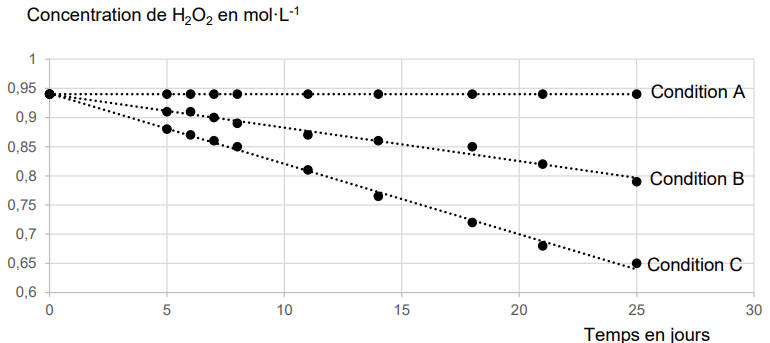 1.
1. En analysant les tracés correspondant aux conditions de conservation A, B et C, préciser les facteurs
d’influence de la conservation de l’eau oxygénée et les conditions optimales de conservation.
L'exposition à la lumière et à une température modérée favorisent la décomposition de l'eau oxygénée.
L'eau oxygénée doit être conservée à l'abri de la lumière et à une température assez basse ( 5 °C).
2. Vérifier que la concentration molaire minimale en peroxyde d’hydrogène dans l’eau oxygénée utilisée pour
la préparation d’une solution hydroalcoolique est de 0,85 mol ⋅ L
−1
.
Pour fabriquer une solution hydroalcoolique, il faut de l’alcool, une solution d’eau
oxygénée contenant du peroxyde d’hydrogène et du glycérol. L’eau oxygénée doit
avoir un pourcentage en masse de peroxyde d’hydrogène au moins égale à 3,0 %.
Soit 3,0 g d'eau oxygénée dans 100 g de solution. ( ou 30 g dans 1000 g de solution.
Masse volumique de cette solution 960 g / L.
Volume de 1000 g de cette solution : 1000 / 960 =1,042 L.
M(H
2O
2) = 34,0 g / mol.
Quantité de matière correspondant à 30 g d'eau oxygénée : n = 30 / 34 =0,882 mol.
Concentration : 0,882 / 1,042 ~0,85 mol / L.
3. Déterminer la concentration en peroxyde d’hydrogène dans la solution contenue dans la bouteille de
l’armoire à pharmacie.
Le
titrage de la solution d'eau oxygénée fait intervenir une
transformation modélisée par une réaction d’oxydoréduction entre le
peroxyde
d’hydrogène H
2O
2 et l'ion permanganate MnO
4
–
.
Toutes les espèces sont incolores sauf l’ion permanganate
qui est de couleur rose violacée en solution aqueuse.
L’équation de la réaction support du titrage est :
2 MnO
4
−(aq) + 5 H
2O
2
(aq) + 6 H
+(aq) → 2 Mn
2+(aq) + 5 O
2
(g) + 8 H
2O(ℓ).
Protocole du titrage :
(a) Prélever, à l'aide d'une pipette jaugée, un volume 𝑉𝑖 = 5,0 mL de la solution d'eau oxygénée
commerciale S et les verser dans une fiole jaugée de volume 𝑉𝑓 = 100,0 mL. Compléter avec de
l'eau distillée en veillant à homogénéiser. Soit S′ la solution obtenue.
(b) Prélever un volume 𝑉
1 = 10,0 mL de la solution S’ et le verser dans un bécher.
(c) Ajouter dans ce bécher quelques gouttes d'acide sulfurique concentré. Mettre en route l’agitation.
(d) Procéder au titrage, avec comme solution titrante une solution de permanganate de potassium de
concentration 𝐶
2 = 2,0 × 10
−2 mol ⋅ L
−1
.
Résultat du titrage :
Le volume équivalent obtenu est 𝑉
𝐸 = 8,9 mL.
A l'équivalence, quantité de matière d'ion permanganate :
n
2 =C
2 V
E =2,0 10
-2 x8,9 10
-3 =1,78 10
-4 mol.
Quantité de matière d'eau oxygénée : n
1 = 5 n
2 / 2=
4,45 10-4 mol.
Concentration de la solution S' : n1 / V1 =4,45 10-4 / (10,0 10-3) =4,45 10-2 mol / L.
Tenir compte de la dilution ; concentration de la solution mère :
4,45 10-2 x100 / 5,0 =0,89 mol / L.
Réponse à la problématique :
La bouteille d’eau oxygénée de l’armoire à pharmacie est conservée à température ambiante et à l’abri de la
lumière.
4. Les conditions restant inchangées, montrer qu’il reste moins de dix jours pour utiliser la solution
commerciale d'eau oxygénée de l’armoire à pharmacie pour préparer une solution hydroalcoolique.
D'après le graphe B, en 10 jours la concentration passe de 0,94 mol / L à environ 0,88 mol / L.
Soit une baisse de (0,94-0,87) / 0,94 =0,065 ( 6,5 %).
Concentration de la bouteille d'eau oxygénée de l'armoire à pharmacie au bout de 10 jours :
0,89 x (1-0,065) =0,83 mol / L, valeur inférieure à 0,85 mol / L.
D'après le graphe B, en 9 jours la concentration passe de 0,94 mol / L à environ 0,89 mol / L.
Soit une baisse de (0,94-0,89) / 0,94 =0,053 ( 5,3 %).
Concentration de la bouteille d'eau oxygénée de l'armoire à pharmacie au bout de 9 jours :
0,89 x (1-0,053) =0,84 mol / L, valeur inférieure à 0,85 mol / L.
D'après le graphe B, en 8 jours la concentration passe de 0,94 mol / L à environ 0,895 mol / L.
Soit une baisse de (0,94-0,895) / 0,94 =0,047 ( 4,7 %).
Concentration de la bouteille d'eau oxygénée de l'armoire à pharmacie au bout de8 jours :
0,89 x (1-0,047) ~0,85 mol / L.
Il reste moins de 8 jours pour utiliser cette eau oxygénée en vue de la préparation hydroalcoolique.
.