A. L'eau salée de la Méditerranée.
A1. Citer la valeur de la concentration minimale en masse c
m
en ion chlorure à partir de laquelle on peut considérer que l'eau
souterraine est contaminée par une intrusion d'eau de mer la rendant
non potable.
200 mg L-1.
A2.1 Sachant que la concentration en chlorure de magnésium dans l'eau de mer vaut c = 4,0 10
-2 mol / L, déterminer la concentration en ion chlorure apportés par MgCl
2(s).
MgCl
2(s) --> Mg
2+aq + 2Cl
-aq.
[Cl
-aq] = 2 c = 8,0 10
-2 mol / L.
A2.2.
La concentration en masse en ion chlorure apportés par le chlorure de
sodium dans l'eau a pour valeur 16,5 g / L. Déterminer la concentration
totale en ion chlorure dans la mer méditerranée.
M(Cl) = 35,5 g / mol ;
16,5 / 35,5 =0,465 mol / L ; 0,465 + 8 10-2 ~0,54 mol / L.
B. Titrage des ions chlorure de l'eau douce des eaux souterraines.
On prélève 50,0 mL d'eau au niveau du pompage. On titre les ions
chlorure de cette solution par une solution de nitrate d'argent de
concentration 1,00 10
-2 mol / L. Le titrage est suivi par conductimétrie.
Ag
+aq + Cl
-aq --> AgCl(s).
B.1. Identifier la courbe représentant l'évolution siùulée de la conductivité de la solution.
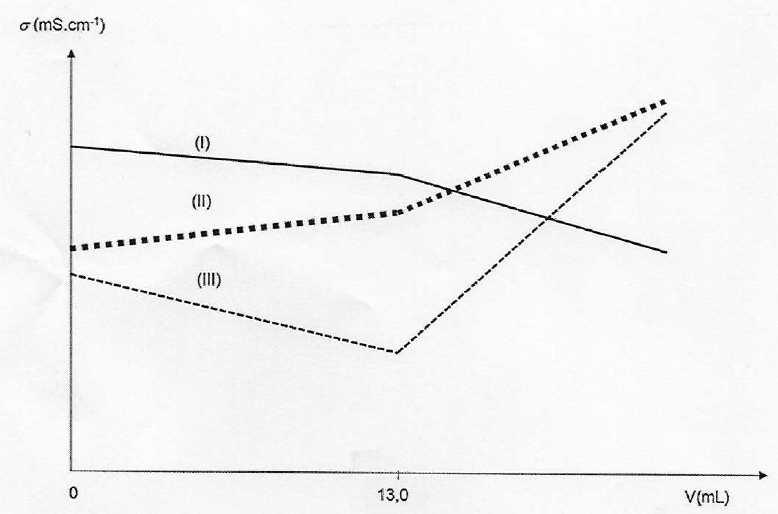 Du point de vue de la conductivité :
Du point de vue de la conductivité :
Avant l'équivalence, Ag+ aq en défaut : tout se passe comme
si on remplaçait les ions chlorures par les ions nitrate de
conductivité molaire ionique moindre. La conductivité de la solution
décroït.
Après l'équivalence, Ag+ en excès : on ajoute des ions nitrate et des ion argent, la conductivité de la solution croît rapidement.
Donc courbe III.
B.2. Véq = 13,0 mL. En déduire si l'eau du prélèvement peut être utilisée en eau potable.
A l'équivalence n(Cl-) = n(Ag+).
CAVA= CB Veq
CA= CB *Veq / VA = 1,00 10-2 x 13 / 50 = 2,6 10-3 mol / L.
Concentration massique en ion chlorure : 2,6 10-3 x 35,5 =9,2 10-2 g / L = 92 mg / L.
Cette valeur étant inférieure à 200 mg/ L, cette eau peut être utilisée en eau potable.