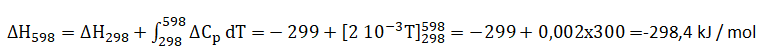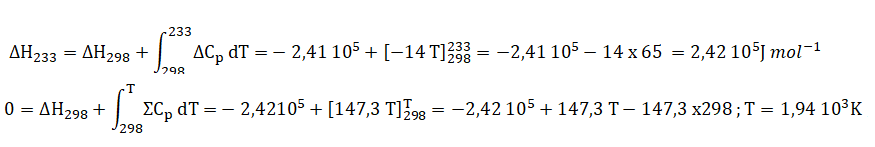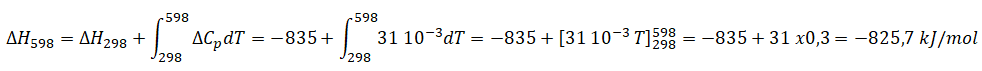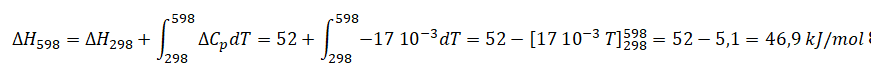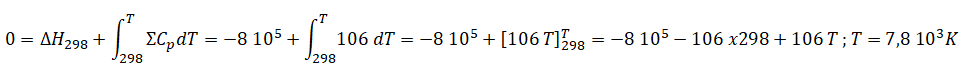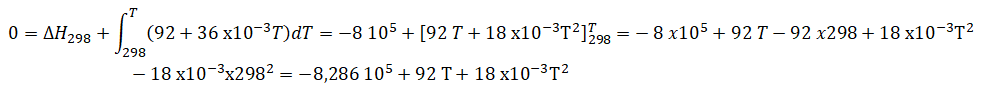Thermochimie
: concours ingénieur.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
1) Donner
les équations de combustion :
C2H4 +3O2 --> 2 CO2
+ 2H2O.
2CO + O2 --> CO2.
2C2H2
+5O2 --> 4CO2 + 2H2O.
2C3H7OH + 9O2 --> 6CO2
+8H2O.
2C3H6O2 + 7O2 --> 6CO2
+6H2O.
2) Pour CHOOH, donnez :
a. L'équation de combustion.
2CHOOH + O2(g) --> 2CO2(g) + 2H2O(g).
b. Le pouvoir comburivore.
CHOOH + 0,5(O2+3,76 N2) --> CO2(g) + H2O(g) +1,88 N2.
Quantité de matière dans 1 kg de combustible : n =1000 / M(CHOOH) = 1000 / 46 = 21,74 mol.
Quantité de matière d'air : 0,5 n = 10,87 mol.
Masse molaire de l'air : 29 g / mol ; masse d'air : 29 x10,87 ~315 g.
Pouvoir comburivore : 0,315 kg d'air pour 1 kg de combustible.
c. Le pouvoir fumigène avec l'eau sous forme de gaz.
Quantité de matière CO2 produite par la combustion d'1 kg de combustible : 21,74 mol.
Masse correspondante : 21,74 x 44 =956,6 g.
Quantité de matière d'eau : 21,74 mol.
Masse d'eau : 21,74 x18=391,3 g.
Masse de diazote : 1,88 x21,74 x28=327 g.
Masse totale des produits : 1,67 kg par kg de combustible.
d. Le pouvoir calorifique inférieur.
CHOOH + 0,5O2 (g)--> CO2(g) + H2O(g).
DH298=
DHf(CO2)
+ DHf(H2O(g))
- DHf(CHOOH) -0,5 DHf(O2).
DH298= -393 -241+379= -255 kJ / mol.
d. Le pouvoir calorifique supérieur.
DH298=
DHf(CO2)
+ DHf(H2O(liquide))
- DHf(CHOOH) -0,5 DHf(O2)
DH298= -393 -285+379= -299 kJ / mol.
e. L'enthalpie de combustion avec l'eau sous forme gazeuse à 598 K.
DCp =Cp°(CO2)+Cp°(H2O)-Cp°(CHOOH)-0,5Cp°(O2)=32 +30-46-14=2 J / mol / K.
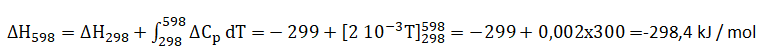
2. bis Pour C2H2, donnez :
a. L'équation de combustion.
C2H2 + 2,5O2(g) --> 2CO2(g) + H2O(g).
b. Le pouvoir comburivore.
C2H2 + 2,5(O2+3,76 N2) --> 2CO2(g) +H2O(g) +9,4 N2.
Quantité de matière dans 1 kg de combustible : n =1000 / M(C2H2) = 1000 / 26 = 38,46 mol.
Quantité de matière d'air : 2,5 n = 96,15 mol.
Masse molaire de l'air : 29 g / mol ; masse d'air : 29 x96,15 ~2,79 kg.
Pouvoir comburivore : 2,79 kg d'air pour 1 kg de combustible.
c. Le pouvoir fumigène avec l'eau sous forme de gaz.
Quantité de matière CO2 produite par la combustion d'1 kg de combustible : 76,92 mol.
Masse correspondante : 76,92 x 44 =3,38 kg.
Quantité de matière d'eau : 38,46 mol.
Masse d'eau : 38,46 x18=0,69 kg.
Masse de diazote : 9,4 x x38,46 x28=10,1 kg.
Masse totale des produits : 14,2 kg par kg de combustible.
d. Le pouvoir calorifique inférieur.
C2H2 + 2,5O2(g) --> 2CO2(g) + H2O(g).
DH298=2
DHf(CO2)
+ DHf(H2O(g))
- DHf(CHOOH) -2,5 DHf(O2).
DH298= -393 -241+379= -255 kJ / mol.
d. Le pouvoir calorifique supérieur.
DH298=2
DHf(CO2)
+ DHf(H2O(liquide))
- DHf(C2H2) -2,5 DHf(O2)
DH298= -2 x393 -285-227= -1298 kJ / mol.
e. L'enthalpie de combustion avec l'eau sous forme gazeuse à 598 K.
DCp =2Cp°(CO2)+Cp°(H2O)-Cp°(C2H2)-2,5Cp°(O2)=64 +30-44-70= -20 J / mol / K.
3. Calculer la puissance thermique d'une chaudière à condensation qui brûle 10 m 3 par heure de méthane ( PCI = 35,9 kJ / L).
En considérant tous les gaz comme parfaits, déduisez en les débits d'air et de fumées si on utilise un excès d'air de 30 %.
Puissance thermique : 35,9 x 10 000 / 3600=99,7 kW.
CH4 + 2(O2+3,76 N2) --> CO2(g) + 2H2O(g) +7,52 N2.
Débit d'air : 2 x 1,3 x10 =26 m3 / heure.
Débit des fumées : 1 +2+1,3 x7,52 +2 x0,3=13,4 m3 / heure.
4. Calculer la
température de flamme du dihydrogène dans de l'air au double de la
stoechiométrie en introduisant les réactifs à la température de -40 °C
en considérant les capacités calorifiques constantes et en ignorant les
effets des dissociations.
H2(g) +0,5 O2 --> H2O(g).
DCp =Cp°(H2O)-Cp°(H2)-0,5Cp°(O2)=28 -28-14= -14 J / mol / K.
H2(g) + (O2+3,76 N2) --> H2O(g) +0,5 O2+3,76 N2.
Somme des Cp
des produits de la réaction : 0,5C°P(O2)+C°P(H2O)+3,76 C°p(N2) =14 +28+3,76 x28 =147,3 J mol-1
K-1.
Dans l'hypothèse d'un système adiabatique et en ignorant les
dissociations, la chaleur libérée par la combustion chauffe les
produits de cette réaction :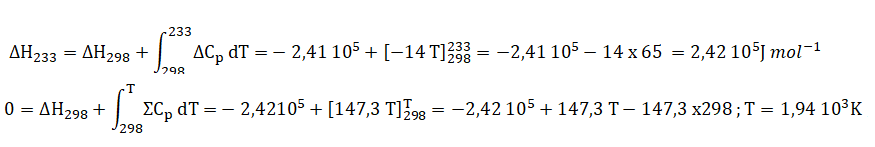
5. Calculer l'excès d'air nécessaire pour avoir une température de flamme de 1400 °C ( 1673 K).
C3H8(g) + (5+n)(O2+3,76 N2) --> 3 CO2 +4H2O(g) +n O2+(5+n)3,76 N2.
Somme des Cp
des produits de la réaction :
3 C°p(CO2)+ 4C°P(H2O)+(5+n)3,76 C°p(N2) +n C°p(O2)=3 x32 +4 x30+(5+n) x3,76 x28+30n =742,4+135,28 n J mol-1
K-1.
0 = -2,22 106 +(742,4+135,28 n) x (1673-298)
0 = -2,22 106 +(742,4+135,28 n) x 1375.
2,22 106 / 1375=742,4+135,28 n.
n = 6,45 mol.
|
...
|
....
|
1) Donner
les équations de combustion :
C8H8 +10O2 --> 8 CO2
+ 4H2O.
2CO + O2 --> CO2.
2CH2O2
+O2 --> 2CO2 + 2H2O.
4NH2CH2COOH + 11O2 --> 8CO2
+10H2O +4NO.
2) Donnez la
composition des fumées pour la combustion d'une mole de C2H6
avec un facteur d'air de 1,1.
2C2H6 (g) +7 O2 (g) --> 4CO2(g)
+ 6H2O(g).
L'air est en excès.
Quantité d'air (21 % de dioxygène) strictement nécessaire ou pouvoir
comburivore Va : 7 / 0,21=33,3 mol.
Facteur d'air = volume d'air réel / Va = 1,1 ; volume d'air réel =1,1 x33,3 =36,7 mol.
Les fumées contiennent :
4 moles de dioxyde de carbone ; 6 moles de vapeur d'eau ;
36,7 x0,79~29 mol de diazote ;
36,7 x0,21 -7=0,7 mol de dioxygène.
3) Calculer
l'enthalpie de combustion à 298 K et à 598 K des espèces suivantes : CH3COOH
et dicarbone C2.
CH3COOH + 2O2 --> 2CO2 + 2H2O.
DH298=2
DHf(CO2)
+2 DHf(H2O)
- DHf(CH3COOH) -2 DHf(O2.
DH298=
-2 x393 -2 x241 +433 = -835 kJ / mol.
DCp
=2C°P(CO2)+2C°P(H2O)-C°P(CH3COOH)-2C°P(O2)=2 x37 +2 x34 -63-2x24=31 J mol-1
K-1.
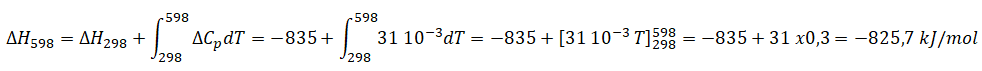
C2 + 2O2 --> 2CO2 .
DH298=2 DHf(CO2) - DHf(C2) -2
DHf(O2.
DH298=
-2 x393 +838 = 52 kJ / mol.
DCp
=2C°P(CO2)-C°P(C2)-2C°P(O2)=2 x37 -43-2x24= -17 J mol-1
K-1.
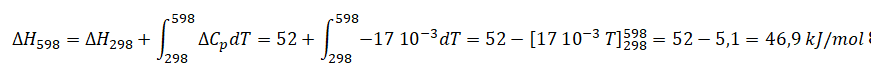
4. Un moteur de fusée utilise du méthane et du dioxygène purs comme ergols
a. Calculer
l'enthalpie de combustion à 298 Kdu méthane
CH4+ 2O2 --> CO2 + 2H2O.
DH298=
DHf(CO2)
+2 DHf(H2O)
- DHf(CH4) - DHf(O2).
DH298=
-393 -2 x241 +75 = -800 kJ / mol.
b. En considérant les capacités calorifiques constantes, calculer la température maximum de la flamme.
Somme des Cp
des produits de la réaction : C°P(CO2)+2C°P(H2O)=40 +2 x33 +40 =106 J mol-1
K-1.
Dans l'hypothjèse d'un système adiabatique et en ignorant les
dissociations, la chaleur libérée par la combustion chauffe les
produits de cette réaction :
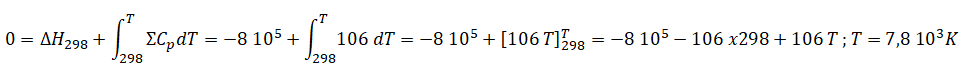
c. En considérant les capacités calorifiques variables avec la température, calculer la température de flamme.
Somme des Cp
des produits de la réaction : C°P(CO2)+2C°P(H2O)=32+22 10-3 T +2 x(7 10-3T +30 )=92 +36 10-3 T J mol-1
K-1.
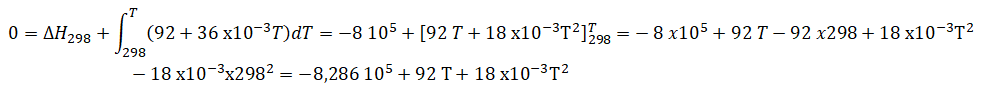
Résolution de cette équation :
discriminant : 922+4 x18 10-3 x8,286 105=6,81 104~2612.
Racine positive retenue : (-92 +261) / (2x18 10-3) ~4,7 103 K.
5. Montrer que la réaction C(s) + H2O --> H2 +CO (a) peut s'écrire à partir dee enthalpies des réactions suivantes :
2 C(s) +O2 --> 2 CO ( b)
H2+0,5O2 --> H2O (c)
0,5 (b) - (c) donne :C(s) + H2O --> H2 +CO.
DH(a) = 0,5 DH(b)- DH(c).
|
|