L'objectif est la synthèse de
l'acide benzoïque à partir du benzaldehyde.
Elle
peut être modélisée par une réaction d'oxydo-réduction dans laquelle un
même réactif, le benzaldéhyde, est à la fois l'oxydant et le réducteur.
On parle de dismutation.
2 C6H5CHO (l) + HO-aq -->
C6H5COO-
aq + C6H5CH2-OH
(l). Réaction 1.
On considère le plongeur et son équipement de centre de masse G
en équilibre à une profondeur de 35 m.
Q1.
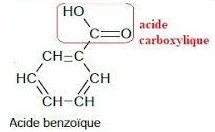
Représenter la formule semi-développée de l'acide benzoïque, entourer
le groupe caractéristique et identifier la famille fonctionnelle
correspondante.
 Q2.
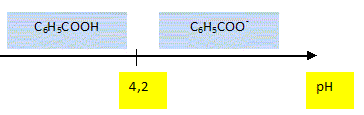
Q2. Justifier à
l'aide d 'un diagramme de prédominance, l'obtention de l'ion benzoate.
pKa(acide benzoïque / ion benzoate) = 4,2 à 25°C.
La réaction s'effectue en milieu basique ( pH > pKa). L'ion benzoate
prédomine.
 Q3.
Q3.
Ecrire la demi-équation électronique modélisant le transfert
d'électrons entre le benzaldehyde C
7H
6O et
l'alcol benzilique
C7H8O.
C7H8O aq --> C7H6O aq +2e-
+2H+aq.
C7H8O aq cède des électrons, il joue le rôle de
réducteur qui s'oxyde.
On donne le protocole expérimental.
1.a. Dans un erlenmeyer dissoudre 10 g de KOH dans 40 mL d'eau
distillée.
1.b. Ajouter 5,0 mL de benzaldehyde. Agiter et laisser sous agitation à
température ambiante pendant 48 heures.
2.c. Ajouter 20 mL d'ether diéthylique, agiter puis transvaser dans une
ampoule à décanter.
2.d. Séparer les phases.
2.e. Récupérer la phase aqueuse et la placer au bain de glace.
3.f. Sous la hotte, ajouter lentement dans la phase aqueuse une
solution d'acide chlorhydrique à pH = 2.
4.g. Filtrer sur Bûchner.
4.h. Introduire le produit obtenu dans un becher avec 10 mL d'eau.
Chauffer et ajouter la quantité d'eau juste nécessaire pour dissoudre
le produit.
5.i. Laisser refroidir lentement puis filtrer sur un entonnoir Büchner
pour récupérer le produit recristallisé
6.j. Placer le produit à l'étuve et peser le produit sec.
6.k. Réaliser la chromatographie sur couche mince du produit obtenu.
On obtient une masse m = 1,1 g de produit.
Q4.
Pour chaque étape indiquer si cette étape correspond à une
tranformation chimique, à une analyse du produit, à une purification ou
à une séparation.
1 :
tranformation chimique.
2. séparation.
3. tranformation chimique.
4 . séparation.
5. purification.
6. analyse du produit..
Q 5. Proposer en
justifiant un dispositif expérimental permettant d'optimiser la vitesse
de formation du produit.
Chauffage
à reflux : la température est un facteur cinétique. Les vapeurs se
condensent dans le réfrigérant et retombent dans le milieu réactionnel
( pas de perte de matière)..
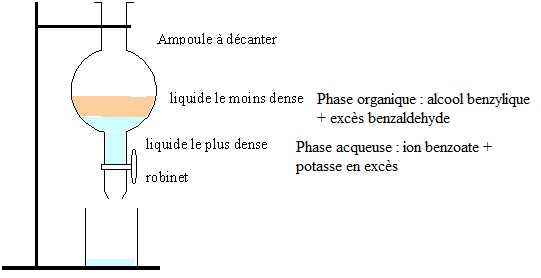
Q 6. Schématiser
l'ampoule à décanter et son contenu.
 Q.7.
Q.7. A l'étape f,
justifier l'apparition d'un solide.
L'ion benzoate est très soluble dans l'eau ; l'acide benzoïque
prédomine à pH = 2 et il est très peu soluble dans l'eau.
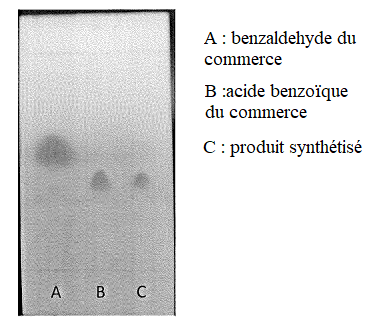
Q.8. Interpréter le
chromatogramme.
Le produit (dépot C) est pur ; on observe une seule tache de même
rapport frontal que l'acide benzoïque ( dépot B).
Q 9. Déterminer le
rendement et commenter.
Potasse : n = m / M(KOH) =10 / 56 ~0,18 mol.
Benzaldehyde : m = volume x densité = 5,0 x1,05 = 5,25 g.
n = m / m(benzaldehyde) = 5,25 / 106 ~0,050 mol ( en défaut).
Quantité de matière théorique d'acide benzoïque : n =0,050 / 2 = 0,025
mol.
Masse théorique = n m(acide benzoïque) = 0,025 x122 ~ 3,1 g.
Rendement = masse réelle / masse théorique = 1,1 / 3,1 =0,35 ( 35 %),
valeur assez faible.