Synthèse
d'un ester à odeur florale, bac Polynésie 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Exercice 1 ( 10
points).
Partie 1. Synthèse du benzoate de méthyle.
Le benzoate de méthyle est obtenu par réaction d'estérification entre l'acide benzoïque de formule C6H5COOH et le méthanol de formule CH3OH en présence d'acide sulfurique.
C6H5COOH + CH3OH = C6H5COOCH3 + D.
1.1 Nommer le groupe caractéristique de la molécule d'acide benzoïque.
Groupe carboxyle ( fonction acide carboxylique ).
1.2. Vérifier que la molécule D correspond à la molécule d'eau.
Bilan sur le carbone : à gauche, 7 carbone ; à droite, 7 atomes de carbone.
Bilan sur l'élément hydrogène : à gauche, 10 élément hydrogène et seulement 8 à droite ( donc D compte 2 H).
Bilan sur l'élément oxygène : à gauche, 3 élément oxygène et seulement 2 à droite ( donc D compte 1 O).
2. Etude du mode opératoire.
Etape 1
: dans
un ballon on introduit 12,2 g d'acide benzoïque, 4,0 mL de méthanol, 3
gouttes d'acide sulfurique concentré et quelques grains de pierre
ponce. On
réalise un montage à reflux sous la hotte et on chauffe doucement
pendant 1 heure.
Etape 2 : après
refroidissement on verse le contenu du ballon dans une ampoule à
décanter contenant 50 mL d'eau distillée froide saturée de chlorure de
sodium. Agiter en dégazant régulièrement et séparer la phase organique
de la phase aqueuse.
Etape 3
: ajouter 50 mL d'une solution aqueuse d'hydrogénate de sodium à
la phase organique, dégaser puis séparer les deux phases après
décantation.
Etape 4 : sécher la phase organique avec du chlorure de magnésium anhydre puis filtrer.
2.1 Quel est le rôle de l'acide sulfurique.
L'acide sulfurique joue le rôle de catalyseur.
Un catalyseur augmente la vitesse de la réaction. La composition du
mélange à l'équilibre n'est pas modifiée.
Le catalyseur intervient lors d'une étape de la réaction et se trouve
régénéré lors de la dernière étape.
2.2 Identifier le montage correspondant à l'étape 1.
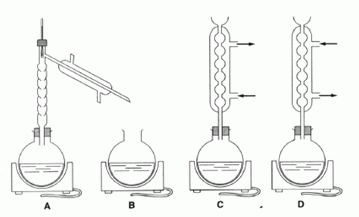
A : montage de distillation ; B : ballon et chauffe ballon ( les vapeurs des réactifs et produits sont perdues).
C convient. Montage de chauffage à reflux.
D : Chauffage à reflux, mais les branchements de l'eau sont inversés.
2.3. Donner un des intérêts du chauffage à reflux.
Le chauffage à reflux permet d'augmenter la vitesse de la réaction en travaillant à température modérée.
On évite les pertes de matière : les vapeurs se condensent dans le réfrigérant vertical et retombent dans le milieu réactionnel.
2.4. Justifier les précautions opératoires et citer les précautions d'usage.
Le méthanol est toxique, inflammable et classé CMR ; l'acide benzoïque est corrosif et classé CMR.
Port de blouse, lunettes et gants ; travail sous hotte aspirante.
2.5. Expliquer le choix d'ajout d'eau salée dans l'étape 2.
L'ester est insoluble dans l'eau salée.
2.6. Identifier les espèces chimiques contenues dans chacune des 2 phases ( étape 2).
Phase aqueuse : eau salée, acide benzoïque, acide sulfurique et méthanol.
Phase organique : benzoate de méthyle.
2.7.
Montrer par l'écriture d'une réaction que l'ajout d'hydrogénate de
sodium permet de transformer l'acide benzoïque en ion benzoate.
C6H5COOH / C6H5COO- : pKa = 4,2.
Acide carbonique CO2, H2O aq / hydrogénocarbonate HCO3- aq pKa = 6,4.
Réaction acide base entre l'acide le plus fort et la base la plus forte :
C6H5COOH aq +HCO3- aq --> C6H5COO- aq + CO2, H2O aq.
|
...
|
....
|
3. Identification de la molécule obtenue
3.1 Montrer que le spectre IR suivant peut correspondre à la fomrule chimique du benzoate de méthyle.
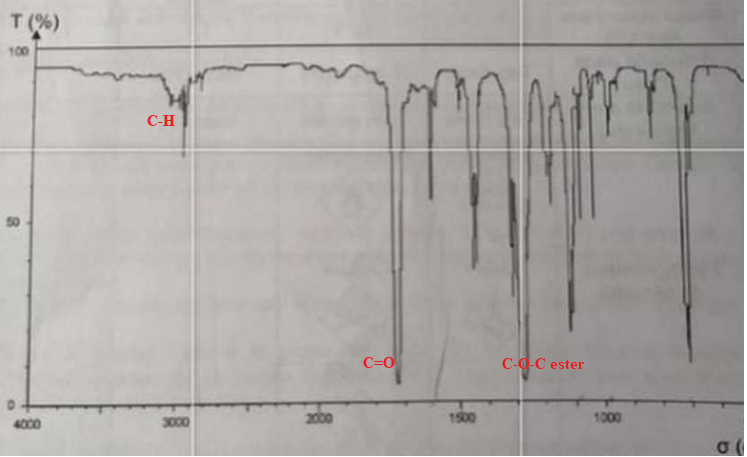
4. Rendement de la synthèse.
4.1 et 2 Déterminer les quantités de matière des réactifs.
Acide benzoïque : nacide = m / M(C6H5COOH) = 12,2 / 122 = 0,10 mol.
Méthanol : masse = volume x masse volumique = 4,0 x 0,79 =3,16 g.
nméthanol = 3,16 / M(méthanol)= 3,16 / 32 =0,09875 ~0,10 mol.
Les réactifs sont introduits en proportions stoechiométriques.
La masse expérimentale d'ester est mexp = 9,11 g.
4.3 Compléter le tableau d'avancement suivant.
Etat
|
Avancement (mol)
|
C6H5COOH
|
+CH3OH
|
= C6H5COOCH3
|
+H2O
|
initial
|
0
|
nacide
|
nméthanol
|
0
|
0
|
intermédiaire
|
x
|
nacide-x |
nméthanol-x
|
x
|
x
|
final
|
xf
|
nacide-xf |
nméthanol-xf |
xf
|
xf
|
|
|
4.4 Déterminer les valeurs des quantités de matière de l'ensemble des espèces présenntes à l'état final.
Dans l'hypothèse d'une réaction équilibrée : nacide éq = nméthanol éq = 0,10 x(1-0,67) =3,3 10-2 mol ; nester éq = neau éq = 0,10 x0,67 6,7 10-2= mol.
4.5 Montrer que le rendement de la synthèse est proche de 67 %.
Mester = 136 g / mol ; nester exp = 9,11 / 136 ~0,067 mol.
Rendement = nexp / néq = 0,067 / 0,10 = 0,67 ( 67 %).
4.6 Proposer une méthode permettant d'améliorer le rendement.
Utiliser l'alcool en excès.
Eliminer l'eau au fur et à mesure de sa formation.
5. Vérification de la quantité de matière en ion benzoate restante à l'aide d'un dosage spectrophotométrique.
Volume de la phase aqueuse V = 100 mL.
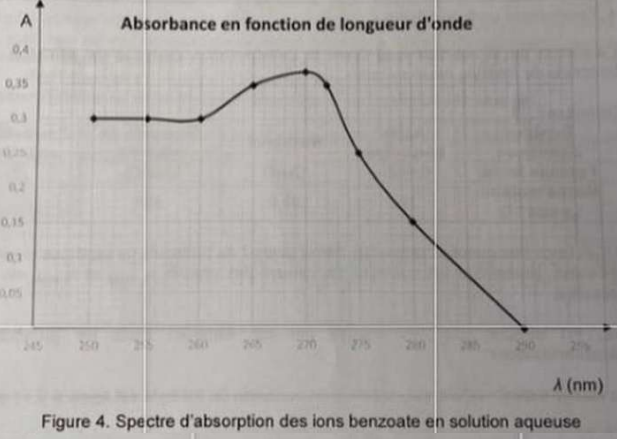
5.1. A quelle longueur d'onde faut-il se placer ?
A la longueur d'onde de 270 nm pour laquelle l'ion benzoate présente un maximum d'absorption.
5.2 Identifier le domaine spectral dans lequel l'absorbance est maximale.
Ultra violet U V.
On dilue 100 fois la solution aqueuse obtenue après la synthèse. La solution fille est notée S.
On réalise à partir d'une solution mère de benzoate de sodium S0 de concentration c0 = 1,0 10-2 mol / L, une gamme étalon.
Solution Si
|
S0
|
S1
|
S2
|
S3
|
S4
|
Concentration ci(mol / L)
|
1,0 10-2
|
7,5 10-3
|
5,0 10-3
|
2,5 10-3
|
1,0 10-3
|
Absorbance A
|
0,880
|
0,661
|
0,441
|
0,221
|
0,087
|
5.3 Indiquer la verrerie permettant de réaliser 100,0 mL de la solution S3 à partir de la solution mère.
Fiole jaugée de 100,0 mL.
Facteur de dilution : F = 1,0 10-2 /(2,5 10-3) =4.
Volume de la pipette jaugée : 100 /4 = 25,0 mL.
On mesure l'absorbance de la solution S : A = 0,29.
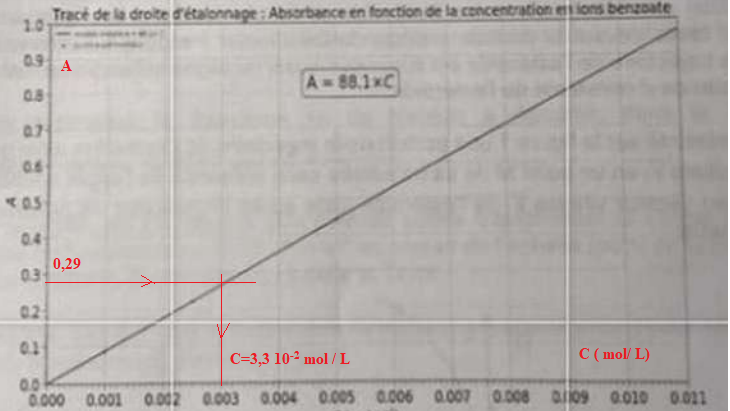
5.4. Montrer que la quantité de matière en ion benzoate n(A-) restante dans la phase aqueuse issue de la réaction est égale à 3,3 10-2 mol / L correspondant également à la quantité de matière d'acide benzoïque restante.
n(A-) =A / 88,1 = 0,29 / 88,1 =3,3 10-3 mol / L.
Tenir compte de la dilution au centième : 100 x 3,3 10-3 = 0,33 mol / L.
Soit 3,3 10-2 mol d'acide benzoïque restant dans 100 mL.
|
|