Le
sel d'oseille, acide oxalique, bac Polynésie 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Première hypothèse :
l'acide oxalique HOOC-COOH est un diacide fort.
1.1
Donner la définition d'un acide selon Brônsted puis justifier le terme
diacide pour l'acide oxalique.
Un acide est une espèce, ion ou molécule, susceptible de céder un
proton H+. L'acide oxalique est susceptible de céder 2
protons, d'où le terme diacide.
1.2.
Représenter la représentation de Lewis de l'acide oxalique ainsi que
celle de l'une des deux formes acido-basique. Justifier le caractère
acide des atomes d'hydrogène.
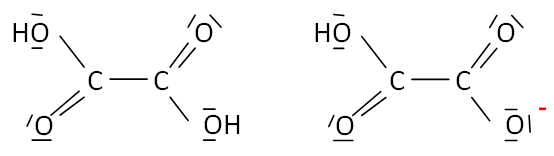
L'atome
d'oxygène, plus électronégatif que l'atome d'hydrogène porte une charge
partielle négative ; l'atome d'hydrogène porte une charge partielle
positive.
1.3.
Donner les deux couples acide / base associés à l'acide oxalique puis
donner la particularité de l'espèce chimique présente dans les deux
couples.
HOOC-COOH / HOOC-COO- ; HOOC-COO- /
-OOC-COO-.
HOOC-COO-
est amphotère, il peut jouer le rôle d'acide ou le
rôle de base.
1.4. Ecrire
l'équation de la réaction modélisant la transformation chimique entre
l'acide oxalique H2A et l'eau. On
considère l'acide oxalique comme un diacide fort.
H2A aq + 2H2O(l)
--> A2-aq +2H3O+aq.
On mesure le pH d'une solution d'acide oxalique de concentration c0
= 5,00 10-2 mol / L : pH = 1,47.
1.5. En déduire, dans le cas de
l'hypothèse diacide fort, que la valeur de la concentration en ion
oxonium H3O+est 0,100 mol / L.
[H3O+ ] = 2 c0 = 0,100 mol / L.
1.6. Calculer la valeur du pH et
conclure.
pH = - log [H3O+ ]= - log (0,1) = 1.
Cette valeur étant différente de la valeur mesurée, l'acide oxalique
n'est pas un diacide fort.
2. Deuxième hypothèse :
l'acide oxalique se comporte comme un monoacide faible.
C0 = 5,00 10-2 mol / L ; pKa de la première
acidité : pKa1 = 1,2.
H2A aq + H2O(l) --> HA-aq
+H3O+aq.
2.1 Ecrire l'équation de la réaction
modélisant la transformation chimique de l'espèce AH
avec l'eau associée à la seconde acidité.
HA- aq + H2O(l) --> A2aq
+H3O+aq.
2.2 A l'aide de la
figure ci-dessous, déterminer la valeur du pKa de la seconde acidité.
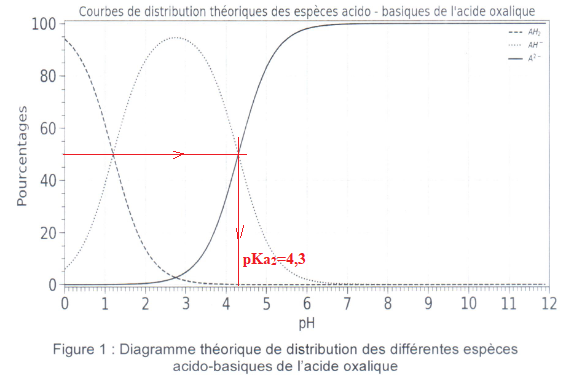
2.3 Donner le
pourcentage approximatif de chaque espèce présente dans la solution
puis justifier que l'on peut émettre l'hypothèse " l'acide oxalique se
comporte comme un monoacide".
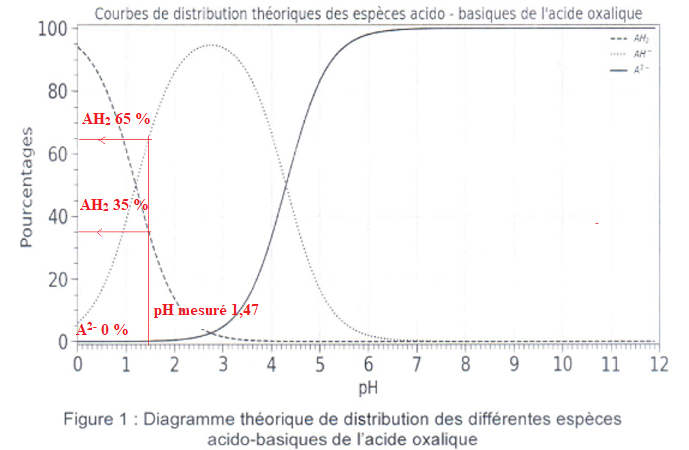
A2- étant quasiment absente, l'acide oxalique se comporte
comme un monoacide faible.
2.4. Exprimer la
constante Ka1.
Ka1 = [H3O+aq] [HA-
aq] / [AH2aq]
2.5 Justifier que
la concentration en ion oxonium, notée h, vérifie l'équation : h2
+Ka1 h -Ka1c0=0.
[H3O+aq]
=[HA- aq], solution électriquement neutre.
[AH2aq] = c0-[HA- aq], conservation de A.
Ka1 = h2 / ( c0-h)
; Ka1 ( c0-h)= h2 ; h2 +Ka1 h -Ka1c0=0.
2.6 Compléter la
ligne 4 du code python permettant de calculer Ka1.
Ka1
= 10-pKa1= 10-1,2 =0,063.
2.7 Justifier le
fait que l'acide oxalique se comporte comme un monoacide faible.
Dans l'hypothèse d'un monoacide fort pH = -log c0 = -
log(0,0500) ~1,3.
Or pH mesuré = 1,47, valeur supérieure à 1,3.
L'acide oxalique se comporte donc comme un monoacide faible.
|
...
|
....
|
Formulation de
l'acide oxalique.
L'acide
oxalique peut se trouver sous deux formes différentes, forme pure ou
forme dihydratée. Un agent de laboratoire trouve un sachet contenant un
solide blanc avec l'étiquette" acide oxalique". Il décide de faire un
titrage avec suivi pHmétrique d'une solution aqueuse de ce solide. Il
dissout m = (0,27 ±0,01 )g de ce solide dans une fiole jaugée de
volume V =( 100,0 ±0,1) mL.
3.1.
Calculer la concentration massique avec son incertitude.
Cm = m / V = 0,27 / 0,100 = 2,7 g / L
u(Cm) =[(u(m) / m)2 +(u(V) / V)2
]½ =[(0,01) / 0,27)2
+(0,1) / 100)2 ]½ =(0,00137
+10-6)½ =0,037 ~0,04.
Cm =(2,7 ±0,1) g / L.
3.2. Justifier le
coefficient 2 devant HO- dans l'équation suivante.
C2H2O4 + 2HO-
--> C2O42- + 2H2O.
L'acide oxalique est un diacide.
3.3. Donner une
caractéristique indispensable de la transformation chimique afin que
l'on puisse l'utiliser dans un titrage direct.
Transformation rapide et totale.
3.4. Définir
l'équivalence et donner la relation entre les quantités de matière des
espèce titrée et titrante.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques.
2n titrée = ntitrante.
L'agent prélève V = 20,0 mL de la solution fabriquée. Concentration de
la solution titrante CB = 0,10 mol / L.
3.5 Proposer un indicateur coloré convenable ainsi que le changement de couleur obtenu.
Bleu de bromothymol : zone de virage 6,0 - 7,6 jaune / bleu.
Rouge de crésol : 7,2 - 8,8 jaune / rouge.
Phénolphtaléine 8,2 - 10 incolore / rose.
Hélianthine 3,1 - 4,4 rouge / jaune.
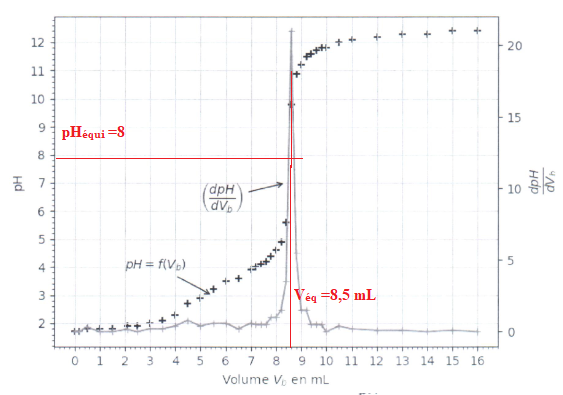
La zone de virage de l'indicateur coloré doit contenir ple pH du point équivalent ( 8 dans ce cas).
Le rouge de crésol convient ; la solution passe du jaune au rouge à l'équivalence.
3.6. Déterminer la concentration en acide oxalique, puis justifier si le solide initial est hydraté ou non.
ntitrante =CB Véq = 0,10 x 8,5 = 0,85 mmol.
n titrée =½ntitrante =0,85 / 2 = 0,425 mmol dans 20,0 mL.
0,425 x 5 = 2,125 mmol dans 100 mL soit dans 0,27 g de solide.
Masse molaire du solide ! M = 0,27 / (2,125 10-3) =127 g / mol.
Il s'agit donc d'acide oxalique dihydraté C2H2O4, 2H2O.
|
|