Ethylotest,
oxydo-réduction, pile, bac STL Mayotte 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Les éthylotests et les éthylomètres sont des détecteurs qui mettent en œuvre des
transformations modélisées par des réactions d'oxydo-réduction pour détecter la présence
d’éthanol dans l’air expiré. Cet exercice étudie leur fonctionnement.
L’éthanol, de formule CH3CH2OH, est l'alcool contenu dans les boissons. Il n'est pas
transformé dans le tube digestif, et passe dans le sang très rapidement après son
ingestion. Après une absorption d’une certaine quantité d’alcool, la concentration en
masse maximale dans le sang en éthanol est appelée « taux d’alcoolémie ». Celle-ci,
atteinte en une demi-heure à jeun ou en une heure après un repas, est proportionnelle à la
concentration en masse d’éthanol dans l’air expiré.
Le seuil toléré est de 0,2 g d’éthanol par litre de sang qui correspond à 0,1 mg
d’éthanol par litre d’air expiré.
D’après sécurité-routière.gouv.fr.
Partie A : L'éthylotest à usage unique.
Aujourd'hui, dans les stations-services, en pharmacie ou en grandes surfaces, on peut
acheter des alcootests jetables. Ils sont constitués d'un sachet gonflable de volume 1,0 L
et d'un tube en verre contenant des cristaux jaunes de dichromate de potassium :
(2K+(aq) + Cr2O7
2−(aq)) en milieu acide.
Lorsque l'automobiliste souffle dans le ballon et fait passer l'air qui contient des vapeurs
d’alcool à travers le tube, les cristaux se colorent en vert.
Si la coloration verte dépasse le
trait témoin sur le tube, le seuil est dépassé et celui-ci est en infraction.
Données : masses molaires moléculaires :
M(K2Cr2O7) = 294,2 g · mol−1 ; M(CH3CH2OH) = 46,0 g · mol−1;
couple oxydant-réducteur pour l’éthanol : CH3COOH(aq)/CH3CH2OH(aq);
couple oxydant-réducteur pour l’ion dichromate : Cr2O7
2−(aq)/Cr3+(aq) .
La transformation chimique mise en jeu dans l'éthylotest consiste en l'oxydation de
l'éthanol par les ions dichromate. Elle est modélisée par la réaction chimique dont
l’équation est la suivante :
3CH3CH2OH(aq) + 2Cr2O7
2−(aq) + 16H+(aq) --> 3CH3COOH(aq) + 4Cr3+(aq) + 11H2O(l)
1. À partir des couples redox fournis, retrouver l’équation bilan de la réaction qui
modélise cette transformation.
Oxydation : 3 fois { CH3CH2OH(aq) +H2O(l)--> CH3COOH aq +4H+aq+4e- }
Réduction : 2 fois {Cr2O7
2−(aq) + 14H+(aq) +6e-.--> 2Cr3+(aq) + 7H2O(l)
}
Multiplier par les coefficients indiqués, puis ajouter et simplifier.
3CH3CH2OH(aq) +3H2O(l) +2Cr2O7
2−(aq) + 28H+(aq) +12e-.--> 3CH3COOH aq +12H+aq+12e- + 4Cr3+(aq) + 14H2O(l).
Lors de l’utilisation d’un éthylotest à usage unique, le test est positif si une masse de
0,425 mg de dichromate de potassium change de couleur.
2. Déterminer la quantité de matière de dichromate de potassium correspondant à
cette masse.
n = m / M = 0,425 / 294,2 =1,44 10-3 mmol.
3. Retrouver la masse d’éthanol contenue dans l’air expiré qui rend le test positif.
n alcool =3 / 2 n = 1,5 x1,44 10-3 =2,17 10-3 mmol.
Masse d'alcool : 2,17 10-3 x 46,0 =9,97 10-2 mg.
Partie B : L'éthylomètre électronique.
Contrairement à l'éthylotest à usage unique, les éthylomètres électroniques sont
réutilisables et fournissent la valeur du taux d’alcoolémie.
Ils sont équipés de cellules qui fonctionnent sur le principe d’une pile à combustible telle
que celle représentée ci-dessous :
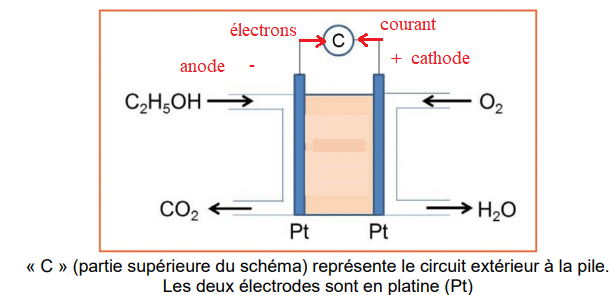
Données :
Couples oxydant-réducteur mis en jeu dans cette pile : CO2(g)/CH3CH2OH(aq) avec la demi-équation électronique associée :
2 CO2(g) + 12 H+
(aq) + 12 e− --> CH3CH2OH(aq) + 3 H2O(𝑙l)
O2(g)/H2O(l) avec avec la demi-équation électronique associée :
O2 (g) + 4H+
(aq) + 4 e− --> 2 H2O(l)
.
La pile ainsi constituée fait circuler un courant électrique dans le circuit extérieur dès
qu’elle fonctionne, c’est-à-dire dès que de l'éthanol est présent dans l’air expiré de la
personne testée.
4. Justifier que le compartiment de droite correspond à la cathode de la pile.
Réduction du dioxygène en eau, donc cathode positive.
5. Faire figurer sur le schéma:
a) la polarité de la pile ;
b) le sens de déplacement des électrons et du courant à l’extérieur de la pile ;
c) le nom de chaque électrode.
6. Écrire l'équation de la réaction qui modélise la transformation chimique lors du
fonctionnement de la pile.
CH3CH2OH(aq) + 3 H2O(𝑙l) --> 2 CO2(g) + 12 H+
(aq) + 12 e− .
3 fois { O2 (g) + 4H+
(aq) + 4 e− --> 2 H2O(l) }
Ajouter et simplifier :
CH3CH2OH(aq) + 3 H2O(l) + 3O2 (g) + 12H+
(aq) + 12 e− --> 2 CO2(g) + 12 H+
(aq) + 12 e− +6 H2O(l).
CH3CH2OH(aq) + 3O2 (g) --> 2 CO2(g) +3 H2O(l).
Partie C : Étude de cas.
Lors d’un accident de voiture, un test d’alcoolémie est réalisé sur un conducteur de 80 kg
qui affirme n’avoir bu qu’une canette de bière de 25 cL à 5,1 degrés.
On calcule le taux d’alcoolémie T (exprimée en g d’éthanol par litre de sang) avec la
relation :
T =V r 10-2 / (K m).
Avec : V : le volume de boisson ingéré en cL ;
r : le degré d'alcool de la boisson ingérée ;
K : le coefficient de diffusion (0,7 pour un homme de 80 kg) ;
m : la masse de l'individu en kg.
7. Déterminer le taux d’alcoolémie de l’homme, exprimé en g d’éthanol par litre de
sang, correspondant à ses affirmations.
T =25 x5,1 10-2 / (0,7 x80)~2,3 10-2 g / L.
L’intensité du courant électrique I débité par la pile de l’éthylomètre est liée à la masse
d’éthanol en mg d’éthanol par litre d’air expiré par la relation malcool = 46,0 /
(1,16 × 102) × I.
Lors du test du conducteur, l’intensité débitée par la pile de l’éthylomètre est de :
I= 0,39 A .
8. Exploiter cette donnée pour savoir si le conducteur dit la vérité sur sa
consommation d’alcool.
malcool =46 x0,39 /116 =3,52 10-3 g = 3,52 mg.
Le seuil toléré est de 0,2 g d’éthanol par litre de sang qui correspond à 0,1 mg
d’éthanol par litre d’air expiré.
3,52 >> 0,1 ; le conducteur a menti.
|
|