Concours
externe adjoint technique de recherche et de formation principal
Grenoble 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
I. Connaissances générales.
1 et 2 Donner la valeur de la célérité de la lumière dans le vide.
3,0 108 m /s.
Donner la valeur de la vitesse du son dans l'air.
340 m /s.
Donner la valeur de la vitesse du son dans le vide.
Le son ne se propageant pas dans le vide, v = 0.
Comparer la vitesse du son dans l'air à la vitesse du son dans l'eau.
Vitesse du son dans l'eau : ~1500 m/s, 4 fois plus grande que dans l'air.
Donner la densité de l'eau et sa masse volumique :
d = 1 ; masse volumique : 1000 kg / m3.
Comparer la masse volumique du polystyrène, du verre et de l'eau.
Polystyrène : 40 kg / m3 ; verre : 2500 kg / m3.
3. Convertir et donner la réponse en notation scientifique.
0,0942 10-3 mm = 0,0942 103 nm= 9,4 101 nm.
1 mm = 106 nm.
137 10-5 dag = 137 10-4 g =137 10-7 kg =1,37 10-5 kg.
0,0036 102 cm3 =0,0036 102 10-3 dm3 =3,6 10-4 dm3.
32,64 km /h = 32,64 / 3,6 m /s =9,07 m /s.
3600 kJ = 3600 / 3600 kWh = 1,0 103 Wh.
4.Calculer
l'énergie consommée pour élever 200 L d'eau de 25°C à 40 °C. Déterminer
la puissance correspondante si cette élévation de température est
réalisée en 3 h 18 min.
Q = m c Dq = 200 x4180 x(40-15) =1,254 107 J ou 1,254 107 / 3600 Wh =3,48 103 Wh.
3 h 18 min = 3,3 h.
Puissance : 3,48 103 / 3,3 =1,05 103 W.
5. Un panneau solaire d'une surface de 1,9 m2 permet de générer une puissance électrique de 360 W sous un éclairement de 1000 W /m2. Déterminer la puissance générée par un champ de 200 m2.
360 x 200 / 1,9 =3,8 104 W.
6.
Sur une échelle 200 000 la distance en ligne droite entre la maison de
Tom et son collège est de 1,25 cm. Déterminer la distance réelle à vol
d'oiseau entre ces deux endroits.
1,25 x 200 000 =2,5 105 cm = 2,5 103 m = 2,5 km.
7.
Une population de 700 individus présente 3 génotypes différents. 336
individus possèdent le génotype 1 et 27 % le génotype 2. Calculer le
pourcentage et le nombre d'individus de génotype 3.
Génotype 2 : 700 x0,27 =189.
Génotype 3 : 700 -336 -189 =175 soit 175 / 700 x100 =25 %.
8. Déterminer la période, la fréquence et l'amplitude du signal suivant.
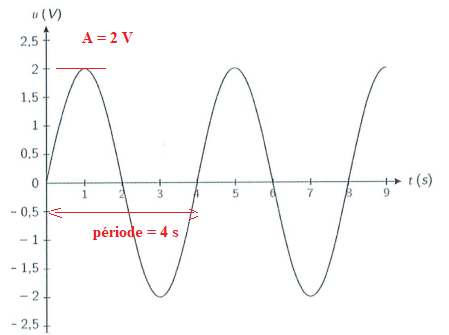
Fréquence = 1 /période = 1 /4 = 0,25 Hz.
9. Compléter le spectre des ondes électromagnétiques.
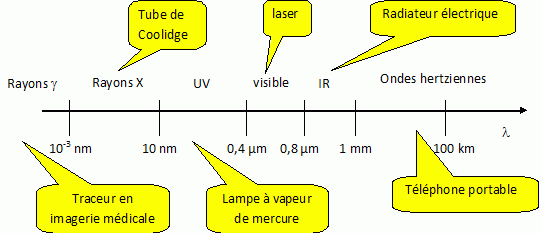
10. Quelle est l'unité de pression dans le système internationnal ?
Le pascal.
11. La force de frottement qui s'applique sur un fluide visqueux en mouvement est F = -h f v avec h est la viscosité du fluide en Poiseuille ( 1 Poiseuille = 1 kg m-1 s-1), f un facteur de forme et v la vitesse.
Déterminer l'unité de f.
Force : N ou kg m s-2. Vitesse : m s-1.
f : kg m s-2 / (m s-1 kg m-1 s-1) soit m.
II Hygiène et sécurité.
1.
A quel danger correspondent les pictogrammes suivants. Donner un
exemple de produit chimique correspondant à chaque pictogramme.

1. Quel est le nom
de la caractéristique C du condensateur ? Préciser son unité. (1 pt)
Capacité en farad (F).
2. Citer 3 EPI et 3 EPC.
EPI : blouse, gants, lunette, chaussures de protection.
EPC : douche, sorbone extractive, filtre particulaire.
3. A quoi correspondent les numéros de téléphone 15, 17 et 18 ?
15 : SAMU ; 18 : pompiers ; 17 : police gendarmerie.
III. Chimie générale.
1. Citer un élément appartenant aux familles suivantes.
métaux alcalins : sodium, potassium.
Halogènes : chlore, iode.
Métaux alcalino-terreux : calcium, magnésium.
Métaux de transition : fer, cobalt.
Gaz rare : hélium, néon.
2. Donner la définition de Brönsted et un exemple.
Acide : espèce susceptible de céder un proton H+.
Acide faible : réaction partielle avec l'eau ( acide acétique).
Acide fort : réaction totale avec l'eau ( acide chlorhydrique)
Base : espèce susceptible de gagner un proton H+.
Base faible : réaction partielle avec l'eau ( ammoniaque).
Base forte : réaction totale avec l'eau ( soude).
3. On dispose de 2 solutions aqueuses, l'une S1 contient 1,35 10-2 mol de chlorure d'hydrogène gazeux dissout dans 150 mL d'eau.
L'autre solution S2 contient 1,35 10-2 mol de soude NaOH dissous dans 100 mL d'eau. Evaluer le pH de ces deux solutions.
S1 : [H+aq] = 1,35 10-2 / 0,150 =0,09 mol / L. pH = - log(0,09) =1,0.
S2 : [HO- ]=1,35 10-2 /0,100 = 0,135 mol / L.
[HO- ]= 10-14 / 0,135 =7,4 10-14 mol / L ; pH = - log(7,4 10-14)=13,1.
4. On dispose de la courbe de dosage acide base suivante.
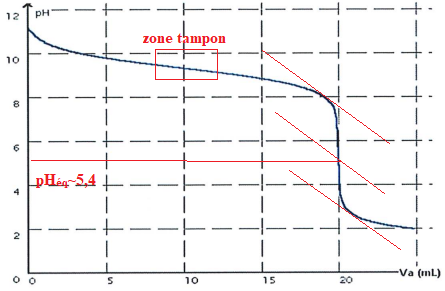
De quel type de dosage s'agit-il ?
Base faible ( solution titrée ) acide fort ( solution titrante).
5. Entourer la zone tampon et définir " solution tampon ".
Un solution tampon modère les variations de pH suite à un ajout d'acide ou de base forte, suite à une dilution modérée.
6. Déterminer graphiquement le point équivalent. En donner la définition.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques.
7. Ecrire l'équation bilan de la réaction de l'acide chlorhydrique sur le fer.
Fe + 2HCl --> FeCl2 + H2 .
8. Equilibrer l'équation suivante.
MnO4- + 8H3O+ + 5Fe2+ --> Mn2+ +12H2O + 5Fe3+.
9 à 12. On dispose
d'une bouteille contenant 1 litre d'acide sulfurique à 95 %. ( densité
1,84). On souhaite réaliser une solution D d'acide sulfurique diluée à
10 %. On dispose d'un erlenmeyer gradué de 2 litres.
Calculer le volume minimum de solution D qu'il est possible de fabriquer.
Masse d'acide : 1,84 x 0,95 =1,748 kg.
Masse molaire M = 98 g / mol.
Concentration : 1748 / 98 =17,8 mol / L.
Prélever 2,0 / 10 = 0,200 L de solution mère ( éprouvette graduée par exemple).
Verser dans une fiole jaugée de 2,0 L contenant 1/3 d'eau distillée. Agiter.
Compléter avec de l'eau distilée jusqu'au trait de jauge. Agiter pour rendre homogène.
13. On souhaite déterminer la concentration d'une solution par spectrophotométrie UV visible.
Faire un schéma du dispositif expérimental.
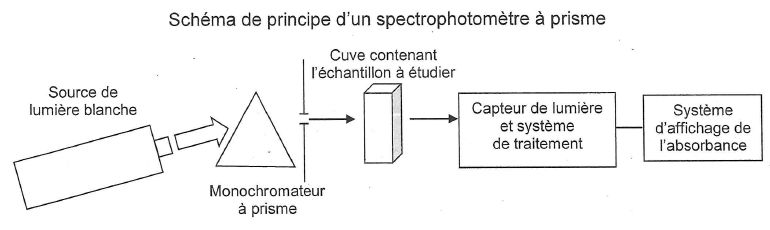 14. Citer la loi de Beer-Lambert en précisant les unités de chaque grandeur.
14. Citer la loi de Beer-Lambert en précisant les unités de chaque grandeur.
A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
15. 16. Décrire le protocole expérimental d'étalonnage du spectrophotomètre.
Faire
le blanc, c'est faire une mesure d'absorbance, à la longueur d'onde
choisie, en mettant dans la cuve uniquement le solvant ( eau et acide
nitrique). Le spectrophotomètre le considèrera comme ligne de base (le
zéro) pour les prochaines mesures.
Déterminer la longueur d'onde du maximum d'absorption de la substance étudiée.
Faire une gamme étalon et mesurer leur ansorbance.
|
...
|
....
|
Physique générale.
1. Dans un circuit électrique, le courant se déplace de la borne positive du générateur vers sa borne négatif.
2. Donner le nombre de protons, neutrons et électrons d'un atomes d'aluminium 27 13 Al.
13 électrons, 13 protons et 27-13 = 14 neutrons.
3. Qu'ont en commun deux isotopes ?
Même nombre de protons, nombre de neutrons différent.
4. Indiquer le nom des changements d'état suivants :
gaz --> liquide : liquéfaction.
gaz --> solide : condensation.
liquide --> solide : solidification.
liquide --> gaz : vaporisation
solide --> liquide : fusion.
solide--> gaz : sublimation.
5. Un plongeur s'immerge dans un lac d'eau douce. Quelle est la pression à 25 m.
Pression atmosphérique : 105 Pa.
Pression à 25 m due à l'eau : reau g h =1000 x 25 x9,8 = 2,45 105 Pa.
Total : 3,45 105 Pa.
6. Ce même plongeur
s'immerge en mer à une profondeur de 25 m où la pression hydrostatique
est égale à 328 635 Pa. Ce plongeur s'immerge t-il en Méditerranée ou
en Mer morte ?
Salinité de la Méditerranée 3,5 % ou 25 g de sel / L.
Salinité de la mer Morte 34,2 % ou 244 g de sel par litre
Méditerranée : d = 1,025 ;
Pression atmosphérique : 105 Pa.
Pression à 25 m due à l'eau : rmer g h =1025 x 25 x9,8 = 2,51 105 Pa.
Total : 3,51 105 Pa.
Mer Morte : d = 1,244 ;
Pression atmosphérique : 105 Pa.
Pression à 25 m due à l'eau : rmer g h =1244 x 25 x9,8~ 3,1 105 Pa.
Total : 4,1 105 Pa.
7. Citer la loi de Snell-Descartes. Faire un schéma.
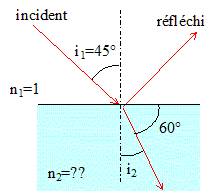
Rayons incident, réfléchi et réfracté sont coplanaires.
L'angle d'incidence est égal à l'angle de réflexion.
Réfraction : n1 sin i1 = n2 sin i2.
8. Définir une lentille convergente et faire un schéma.
9. Définir une lentille divergente et faire un schéma.
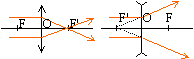
Une lentille convergente réfracte les rayons parallèles en un faisceau convergent en un point.
Une lentille divergente fait diverger un faisceau parallèle de lumière.
10. Expliquer l'évolution des énergies mécanique, cinétique et
potentielle de pesanteur d'une bille lâchée d'une hauteur h en chute
verticale sans vitesse initiale et sans frottement.
L'énergie mécanique reste constante.
L'énergie cinétique augmente et l'énergie potentiellede pesanteur diminue.
On souhaite analyser un circuit comportant une DEL. On dispose d'une DEL rouge, de plusieurs conducteurs ohmiques ( R1 = 1 ohm, R2 = 10 ohms, R3 = 500 ohms, R4 = 10 kW et R5 = 500 kW ) , d'une alimentation stabilisée et de plusieurs multimètres.
11. 12. Schématiser le montage série , le générateur fournit une tension de 10 V
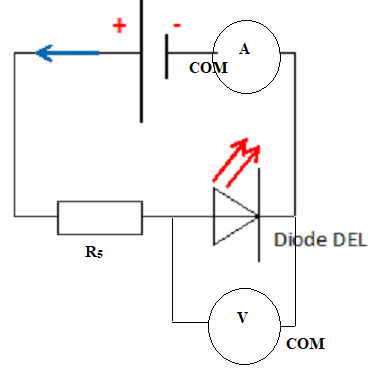
13. Quels calibres va t-on utiliser pour l'ampèremètre et le voltmètre ?
Tension aux bornes de la DEL ; 1,6 à 2 V. ( calibre 2 V).
Intensité du courant I ~ 10 / (5,00 105) =2 10-5 A = 20 µA ( calibre 200 µA).
14. La DEL ne s'allume pas. Pourquoi ?
R5 est trop grande. La DEL s'allume pour une intensité comprise entre 6 à 20 mA.
15. Choisir le conducteur ohmique qui permettra une utilisation normale de la DEL.
Avec I = 20 mA : R = 10 / (20 10-3) = 500 ohms. R3 = 500 ohms peut convenir.
On considère le circuit RLC suivant, soumis à une tension sinusoïdale u(t) = U0 sin(wt+F).
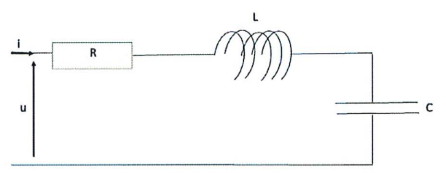
16. Déterminer son impédance Z.
Z = ( R2 +(Lw-1/ (Cw))2)½.
17. En déduire la valeur de la fréquence de résonance si L = 0,1H, R = 1000 ohms, C = 10 µF.
LCw2 = 1 ; w = (1 / (LC))½ =(1 / (0,1 x10-5))½ =103 rad /s.
f = w / (2p) =1000 / 6,28 ~159 Hz.
|
|