Les acides α-aminés, de formule
générale R − CH(NH
2) − COOH, sont les constituants des
protéines,
macromolécules naturelles aux fonctions biologiques multiples. Le plus
simple d’entre eux est la glycine
H
2N − CH
2 − COOH. Dans cette partie, nous allons
nous intéresser à ses propriétés. C’est un solide incolore,
soluble dans l’eau.
Q1. Nommer les
fonctions chimiques présentes dans les acides aminés. Donner le nom de
la glycine en
nomenclature IUPAC.
Fonction amine et fonction acide carboxylique.
Acide 2-aminoéthanoïque.
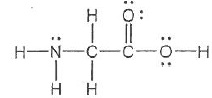
Q2. Donner la
configuration électronique des atomes constituant la glycine. En
déduire le schéma de Lewis
de celle-ci.
C : 1s
2 2s
2 2p
2 ;
N : 1s2 2s2 2p3 ; O : 1s2 2s2 2p4
.
 Q3.
Q3. La glycine présente des propriétés acido-basiques auxquelles
on peut associer deux grandeurs notées pKa1 et pKa2.
a) Donner la définition de la grandeur Ka et de la grandeur pKa associée pour un couple acide/base
de Brønsted.
AH aq + H
2O (l) = A
-aq + H
3O
+aq.
Constante d'acidité Ka = [
A-aq] [H3O+aq ] / [AH aq ]
pKa = - log(Ka).
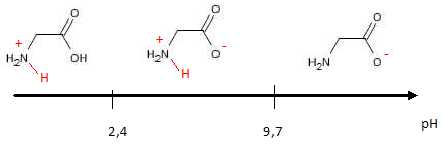
b) En analysant les valeurs pKa1=2,4 et pKa2 =9,6 de la
glycine, montrer que la forme moléculaire
H
2N − CH
2 − COOH est ultra-minoritaire dans l’eau devant la forme
zwitterionique.
c) Établir un diagramme de prédominance de la glycine en précisant les
représentations moléculaires
des espèces majoritaires dans chaque domaine.
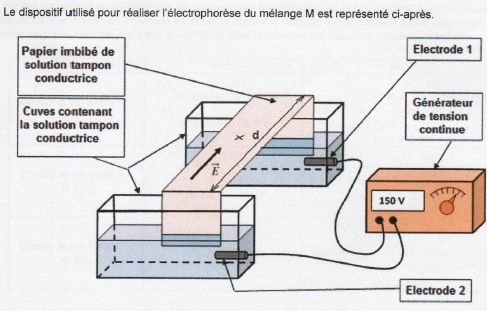
On s’intéresse à présent à l'électrophorèse, technique
chromatographique mettant en jeu la migration
de particules chargées sous l'action d'un champ électrique. Elle permet
de séparer et d’analyser un mélange
de plusieurs acides aminés.
L'échantillon à analyser (contenant le mélange d’acides aminés) est
déposé au centre d'un support solide
conducteur soumis à un champ électrique entre ses deux extrémités.
On appelle pH isoélectrique d'une espèce chimique, noté pI, le pH pour lequel cette espèce ne migre pas
dans un champ électrique. On peut prévoir la valeur du pI en calculant le pH pour lequel la charge nette de
l’espèce étudiée est nulle, à partir des valeurs pKa associées aux propriétés acido-basiques des différents
groupements ionisables de la molécule.
Q4. Démontrer que le pI isoélectrique de la glycine est égal à pI = (pKa1 + pKa2) ⁄ 2.
Fractions molaires des différentes espèces :
x(AH
2+) =
[AH2+ ]éq / Ctot ; x(AH) = [AH ]éq / Ctot ; x(A-) = [A- ]éq / Ctot ;
charge moyenne : 1. [AH2+ ]éq +0. [AH ]éq -1 [A- ]éq .
A pI la charge est nulle : [AH2+ ]éq = [A- ]éq .
Ka1 = [ AH] [H3O+ ] / [AH2+ ].
Ka2 = [A- ] [H3O+ ] / [AH ].
[AH2+ ] = [ AH] [H3O+aq ] / Ka1.
[A- ] =Ka2 [AH ] / [H3O+ ].
[ AH] [H3O+ ]2 = Ka2 Ka1[AH ].
[H3O+ ]2 = Ka2 Ka1.
2 log[H3O+ ] = log (Ka1) +log(Ka2)
pI = (pKa1 + pKa2) ⁄ 2 = (2,4 +9,6) / 2 = 6.
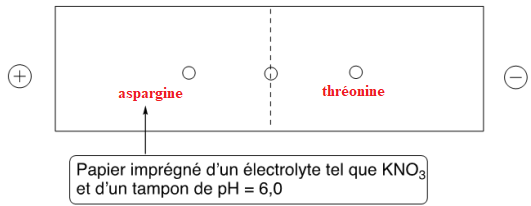
Un mélange de trois acides aminés : glycine, asparagine et thréonine est déposé sur la ligne
centrale. Résultat de la séparation par électrophorèse d’un mélange de glycine, asparagine et thréonine.
 Q5.
Q5. Détailler la démarche permettant d’identifier les trois acides aminés sur le résultat de l’électrophorèse,
puis positionner qualitativement les trois acides aminés à la fin de l’expérience.
Aspargine : pKa1 = 2;2 ; pKa2 = 8,7. pI = 5,45
A pH = 6, la charge globale est négative.
Thréonine : pKa1 = 2,6 ; pKa2 = 10,4. pI = 6,5.
A pH = 6, la charge globale est positive.