Obtention de la (-)-cystéine par électrosynthèse.
La cystéine (notée RSH) est obtenue par réduction électrochimique de la cystine ( notée RSSR) en milieu acide.
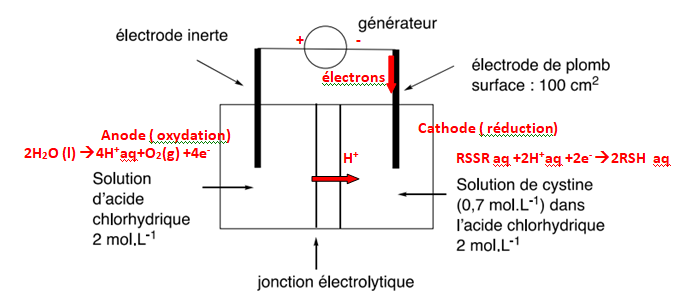
La cellule d'éllectrolyse est représentée ci-dessous. Une membrane
sépare les compartiments anodique et cathodique et permet le passage
des ions hydrogène H
+. l'électrolyte est une solution d'acide chlorhydrique, la tension d'électrolyse est de 3,0 V.
Q18. Recopier le
schéma de la cellule et le compléter en indiquant le sens de
branchement du générateur, l'anode, la cathode, le sens de
déplacement des porteurs de charge et les réactions
électrochimiques ayant lieu à chaque électrodes.
 Q 19.
Q 19. Le rendement faradique est de 90 %, déterminer l'énergie nécessaire pour produire 50 g de cystéine.
M (RSH) =M(C
3H
7NSO
2)=3 x12 +7 +14 +32 +2 x16=121 g / mol.
n = m / M = 50 / 121 =0,41 mol.
Quantité de matière d'électrons : n(e
-) = 0,41 mol.
Charge électrique Q = 0,41 x96500 =4,0 10
4 C.
Energie E = Q U = 4,0 10
4 x 3 =1,2 10
5 J.
Tenir compte du rendement : 1,2 10
5 / 0,9 =
1,3 105 J.
Propriétés oxydantes de la cystéine.
On étudie la réaction d'oxydation de la cystéine par le peroxyde d'hydrogène H
2O
2
en milieu tamponné aqueux sur une gamme de pH allant de 4 à 13 et pour
des rapports variables de concentrations initiales en réactif.
2RSH + H
2O
2 = RSSR + 2H
2O.
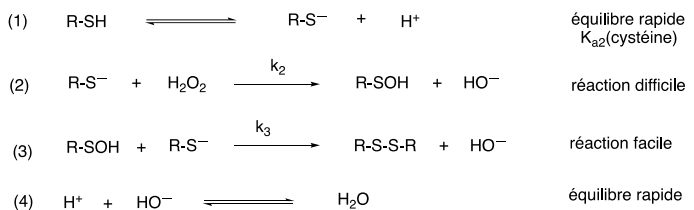
Pour expliquer cette transformation à l’échelle microscopique le mécanisme présenté dans la figure ci-dessous est
postulé. Dans ce mécanisme, les hypothèses suivantes, i) et ii), sont considérées :
i) les actes [1] et [-1] sont
en pré-équilibre rapide ;
ii) l'acte [3] est beaucoup plus facile que l’acte [2].
Les intermédiaires réactionnels
sont R − SOH et R − S
− .
Le but de l’étude est de vérifier si le mécanisme modèle proposé est compatible
avec les données expérimentales.
 Q20.
Q20. Expliquer l’Approximation des États Quasi Stationnaires (AEQS), puis indiquer en justifiant la réponse
s’il est possible d’appliquer cette approximation à chacun des intermédiaires réactionnels.
Dans cette approximation, les espèces chimiques intermédiaires sont
consommées au fur et à mesure qu'elles sont produites. Leurs
concentrations sont donc très faibles et constantes.
R-SOH est produit dans la réaction (2) et immédiatemment consommée dans
la réaction (3). Sa concentration est faible et constante. Cette
approximation s'applique.
R-S
- est produite lors de l'équilibre (1). R-S
- est consommée rapidement si R-SOH est déja présent. Cette approximation ne s'applique pas.
Q21. Montrer en utilisant le mécanisme réactionnel , que dans le cas d’un milieu réactionnel
tamponné, la loi de vitesse de la réaction s’écrit : v = k [RSH) [H
2O
2],
k étant une constante dont
l’expression sera donnée.
v = d[RSSR] /dt = k
3 [RSOH] [RS
- ].
L'équilibre (1) conduit à : k
a2 = [ RS
- ] [H
+ ] / [RSH].
[RS- ] = ka2[RSH] / [H+ ]
L'approximation AEQS s'applique à RSOH :
d(RSOH] / dt = k
2[RS
- ] [H
2O
2] -k
3 [RSOH] [RS
- ]= 0.
k2 [H2O2] =k3 [RSOH] .
Par suite v = k2 ka2 [H2O2] [RSH] / [H+ ].
k = k2 ka2 / [H+].
L’étude expérimentale décrite ci-dessous est proposée, en regard de la modélisation proposée ci-dessus.
Expérience n°1 :
[𝑅SH]
0 = 40,0 mmol∙L
-1 ; [H
2O
2]
0 = 400 mmol∙L
-1 ; pH fixé par une solution tampon : pH = 6,0 ; T= 25°C.
t(s)
|
0
|
5
|
10
|
15
|
20
|
40
|
60
|
[RSH] mmol / L
|
40,0
|
24,7
|
15,2
|
9,4
|
5,8
|
0,84
|
0,12
|
| [RSH] / [RSH]0 |
1
|
0,62
|
0,38
|
0,235
|
0,145
|
0,021
|
0,003
|
ln([RSH] / [RSH]0)
|
0
|
-0,48
|
-0,97
|
-1,45
|
-1,93
|
-3,86
|
-5,8
|
Q22. Montrer que les expériences n°1 et n°2 mises en œuvre permettent de valider le mécanisme postulé.
Déterminer, à partir de ces résultats expérimentaux, la valeur de k.
Dans l'expériennce 1, H
2O
2 est en large excès :
[H2O2] ~ [H2O2]0.
v ~ k [RSH] [H2O2]0,
v = -0,5 d[RSH] /dt.
d[RSH] /dt = -2 v = 2k[H2O2]0[RSH].
d[RSH] / [RSH] = -2k[H2O2]0 dt.
Intégrer : ln[RSH] = -2 k[H2O2]0 t + Cste.
A l'instant initial : Cste = ln[RSH]0.
ln([RSH] /[RSH]0 )= -2 k[H2O2]0 t.
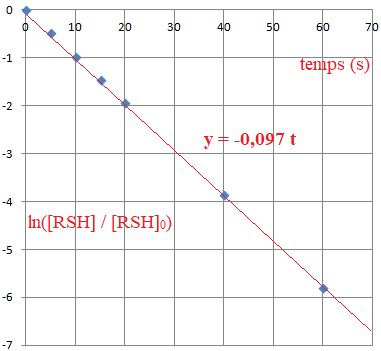
Le graphe étant une droite, il y a accord avec le mécanisme proposé.
- 2k[H2O2]0 = -0,097 ; k = 0,097 / (2 x 0,400 ); k = 0,12 L mol-1 s-1.
Expérience n°2 :
[𝑅SH]0 = 40,0 mmol∙L-1 ; [H2O2]0 = 20 mmol∙L-1 ; pH fixé par une solution tampon : pH = 6,0 ; T= 25°C.
t(s)
|
0
|
10
|
50
|
100
|
500
|
1000
|
2000
|
[RSH] mmol / L
|
40,0
|
38,1
|
32,2
|
27
|
11,7
|
6,9
|
3,7
|
Vitesse initiale expérience 1 :
v01 = -0,5 D [RSH] / Dt = -0,5 (24,7 -40) / (5-0) = 1,53 mmol L-1 s-1.
Vitesse initiale expérience 2 :
v02 = -0,5 D [RSH] / Dt = -0,5 (38,1 -40) / (10-0) = 0,095 mmol L-1 s-1.
v01 / v02 =1,53 / 0,095 ~ 16.
Or v0 = k [RSH]0 [H2O2]0.
[RSH]01 = [RSH]02 ;
v01 / v02 = [H2O2]01 / [H2O2]02 = 400 / 20 = 20, valeur cohérente avec 16.