Analyses
du lait,
concours CAPLP maths sciences 2022
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
Partie A 1 : Analyse du taux d’acidité du lait.
A 1.1 : Autour de l’acide lactique.
1. Justifier que le nom de l'acide lactique est dans la
nomenclature officielle : acide 2-hydroxypropanoïque. La chaine principale compte 3 atomes de carbone ; " propan";
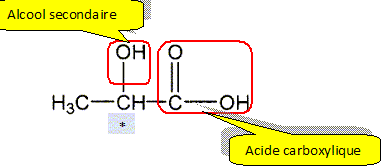
il s'agit d'un acide carboxylique : acide propanoïque ;
un groupe hydroxy OH est fixé sur le carbone n° 2 : acide 2-hydroxypropanoïque.
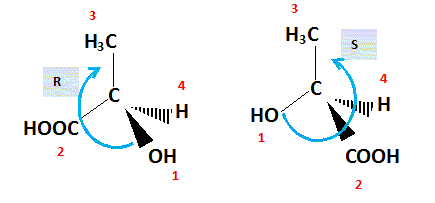
2. Cette molécule possède t elle des stéréo isomères ? Si tel est le
cas, donner la représentation de Cram de chacun de ces stéréo isomères
et indiquer la relation qui les lie.
La présence d'un atome de carbone asymétrique conduit à l'existence de deux énantiomères.
A 1.2 : Étude du lait frais par titrage pHmétrique.
On verse 10,0 mL de lait dans un erlenmeyer et on ajoute 2 gouttes d’un
indicateur coloré bien choisi.
On procède au titrage de l’échantillon de lait par une solution
d’hydroxyde de sodium (Na+(aq) + HO–(aq)) de concentration molaire 0,11
mol.L-1, appelée alors soude « Dornic ».
La persistance d’une nouvelle coloration est observée à partir d’un
volume de solution titrante versée de 1,4 mL.
3. Écrire l’équation de la réaction de titrage en supposant que le seul
acide présent dans le lait est l'acide lactique et calculer sa
constante de réaction K. Conclure. pKa (acide lactique/ion lactate) = 3,9 à 25 °C
On note RCOOH l'acide lactique.
RCOOH aq + HO-aq --> RCOO-aq + H2O(l).
K = [RCOO-aq] / ([RCOOH aq] [ HO-aq]) = [RCOO-aq][H3O+aq] / ([RCOOH aq] [ HO-aq][H3O+aq]) = Ka / Ke.
K = 10-3,9 / 10-14 =1010,1 ~1,3 1010, valeur très grande, la réaction est totale.
4. Sachant que le pH à l’équivalence est de 9,2, choisir un indicateur
coloré convenable. Quel changement de couleur est observé ? Pourquoi
n'ajoute t on que deux gouttes d’indicateur coloré ?
La zone de virage de l'indicateur coloré doit contenir le pH du point
équivalent. Bleu de Thymol. La solution passe du jaune au bleu.
Le
bleu de thymol appartient à un couple acide/base dont les deux espèces
ont une couleur différente. La forme acide réagit donc avec l'ion
hydroxyde lors du titrage ; si on ajoutait une quantité importante
d'indicateur coloré, le volume équivalent serait faussé.
5. En exploitant le résultat du titrage, déterminer si le lait analysé
est frais selon la norme en vigueur.
Quantité de matière de soude à l'équivalence : 0,11 *1,4 10-3=1,54 10-4 mol
Quantité de matière d'acide lactique dosé : 1,54 10-4 mol dans 10,0 mL de lait soit 1,54 10-2 mol par litre.
Masse molaire de l'acide lactique : M =3*12+6+3*16=90 g/mol.
Masse d'acide lactique dans un litre de lait : 90*1,54 10-2 ~1,4 g /L soit 14 °D.
Cette valeur étant inférieure à 18°D, le lait est frais.
6. Faire preuve d’esprit critique sur le dosage réalisé et proposer une
amélioration.
Le volume à l'équivalence est trop petit, ce volume est donc imprécis.
Doser par exemple 100 mL de lait au lieu de10 mL. Véq ~ 14,0 mL
On bien diluer 10 fois la solution de soude.
7. Quel intérêt pratique y a t il à choisir de la soude Dornic pour
mesurer l'acidité d'un lait ?
Le volume de soude versé à l'équivalence multiplié par 10 donne directement le degré Dornic.
Partie A 2 : Analyse d'un lait potentiellement mammiteux.
Dans un laboratoire d'analyse, une technicienne titre 20,0 mL de lait
mélangé à 200 mL d'eau déminéralisée par une solution de nitrate
d'argent (Ag +(aq)+NO 3−(aq)) de concentration 5,00.10 -2 mol.L -1. Le titrage est suivi par conductimétrie.
Le volume équivalent déterminé par la technicienne a pour valeur V éq = 11,6 mL.
A 2.1 : Étude de la sonde
8. Quelle est la fonction d’un conductimètre ?
Mesure de la conductivité d'une solution.
9. Proposer un
protocole permettant de suivre l’évolution de la conductivité de la
solution lors du titrage si vous n’avez pas d’électrode à disposition
mais des plaques de platines.
La
cellule conductimétrique est constituée de deux plaques rectangulaires
de platine platinés, de surface S, parallèles à une distance l sur un
support en verre. On mesure la résistance R ( ohm) du volume de liquide
délimité par les plaques ; la cellule indique la conductance G = 1/R (
siemens ).
10. Pourquoi utiliser du courant alternatif dans un conductimètre ?
En courant alternatif, on n'observe pas de dépôts permanents ou de
dégagement de gaz modifiant la nature des électrodes : en conséquence
la conductance de la tranche de solution située entre les électrodes ne
change pas.
A 2.2 : Étude du lait frais par titrage conductimétrique
11. À partir de
l'équation de la réaction de dosage (formation d’un précipité de
chlorure d’argent), déterminer parmi les représentations graphiques
suivantes, celle qui représente l'allure de l'évolution de la
conductivité σ du mélange en fonction du volume V de solution de
nitrate d'argent versé. Justifier.
Avant l'équivalence tout revient, du point de vue de
la conductivité, à remplacer les ions chlorure par les ions nitrate de
conductivité molaire ionique moindre : donc s diminue légerement.
Après l'équivalence tout revient, du point de vue de la conductivité, à ajouter des ions argent et nitrate donc s augmente plus rapidement.
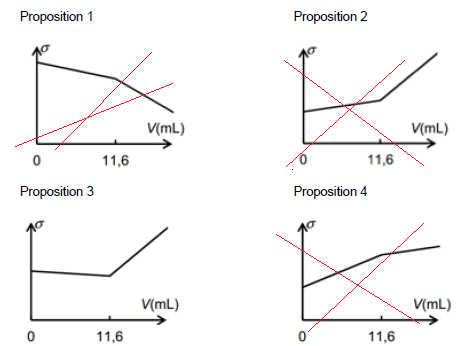 12.
12. Conclure si le lait analysé est « mammiteux » ?
Ag + aq + Cl -aq --> AgCl(s).
A l'équivalence n(Ag +) =n(Cl -) = 5,00 10 -2 x 11,6 10 -3 =5,8 10 -4 mol dans 20,0 mL de lait.
[Cl -]=5,8 10 -4 / (20 10 -3)=2,9 10 -2 mol / L.
Concentration massique en ion chlorure : 2,9 10 -2 x35,5 =1,03 g / L, valeur inférieure à 1,4 g / L ; ce lait n'est pas mamiteux.
|
Partie A 3 : Analyse du taux de radioactivité.
A 3.1 : L’iode 131
L’iode 131 est radioactif β- .
13. Ecrire l’équation de désintégration de l’iode 131 et préciser la notation symbolique du noyau fils obtenu.
13153I --> 13154Xe+ 0-1e
14. Donner la définition de la demi vie t½
et en exploitant le document réponse 1 à rendre avec la copie,
déterminer sa valeur. Les constructions graphiques aidant à trouver la
réponse devront être apparentes sur le document réponse 1.
A t½, l'activité initiale est divisée par deux.
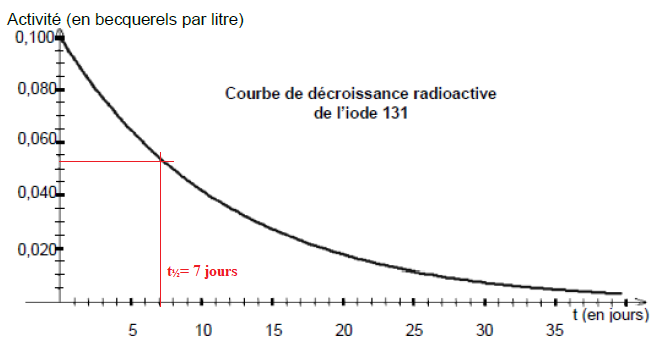
15. Vérifier qu’au bout de 32 jours, la valeur de l’activité mesurée n’est plus quantifiable.
Loi de décroissance radioactive A = A0 exp(-lt).
l = ln(2) / t½ =ln(2) / 7 ~9,9 10-2 j-1.
A = 0,1 exp(-9,910-2 x32) ~4,2 10-3 Bq / litre, valeur inférieure à 0,01 Bq / litre ; l’activité mesurée n’est plus quantifiable..
A 3.2 : Le césium 137
16. Quel est le lien entre le césium 134 et 137 ? Le définir.
Ce sont deux isotopes, ils ne diffèrent que par leur nombre de neutrons.
17. À partir de la loi de décroissance radioactive, démontrer la relation suivante : l =ln(2) / t½. où l représente la constante radioactive de l’élément radioactif considéré et t½ sa demi-vie.
A t½, l'activité initiale est divisée par 2 : ½A0 = A0 exp(-lt½).
½ = exp(-lt½) ; ln(0,5) = -ln(2) = -lt½ ; l =ln(2) / t½.
18. En déduire la valeur de la constante radioactive du césium 137 en s-1.
t½ =30 ans = 30 x365 x24 x3600 =9,46 108 s.
l =ln(2) / (9,46 108) ~7,3 10-10 s-1.
19.
Déterminer le nombre de noyaux radioactifs de césium 137 présents dans
un litre de lait et vérifier que le taux évoqué dans l’article du
document 4 est effectivement très faible.
Les niveaux d’activités mesurés , 0,58 Bq L-1 (a u lieu de 0,22 Bq L-1
pour la valeur normale), correspondent à des valeurs dont l’origine est
attribuable là aussi aux rejets de l’accident de Fukushima.
A = l N ; N=0,58 / (7,3 10-10 )=7,9 108 noyaux de césium 137 par litre de lait.
Le plafond maximal fixé par les autorités étant de 2,7.1011 noyaux de césium 1 37 par litre, le niveau mesuré n'est pas tel qu'il puisse avoir des conséquences sur la santé" .
Partie A-4 : Gestion des fluides suite aux analyses.
Les échantillons de lait d’un volume V = 445 L sont stockés dans une cuve de section S = 0,60 m2.
L’évacuation du lait, non conforme aux analyses, est réalisée par
l’intermédiaire d’un tuyau, de rayon r = 20 mm et de surface s <<
S, placé en bas de la cuve.
La hauteur initiale du liquide est h = 70 cm dans la cuve par rapport au tuyau.
20. À partir de
l’expression de la loi de Bernoulli en régime stationnaire, déterminer
l’expression de la vitesse d’évacuation du lait v (formule de
Torricelli) ainsi que sa valeur numérique au début de l’évacuation du
lait.
p + rgz + ½rv2 = constante. g représente la valeur du champ de pesanteur terrestre.
Appliquer cette relation entre A (surface de la cuve) et B ( sortie du tuyau) :
état A : pression p0 ; altitude h, vitesse voisine de zéro.
état B : pression p0 ; altitude nulle, vitesse v.
p0 + rgh = p0 + ½rv2 ; v2 =2gh ; v = (2gh)½ =(2 x 9,81 x0,70)½~3,7 m /s.
21. Sachant que la durée de vidange a pour formule t =S / s (2h / g)½, en déduire sa valeur en minutes.
s =pr2 =3,14 x0,022=0,00126 m2.
t=0,60 / 0,00126 x(2 x0,7 / 9,81)½~180 s ou 3 minutes.
|
|



