Chimie,
QCM,
Concours ESA 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Exercice 5. (2 points). La vitamine B5 est synthétisée selon l'équation ci-dessous :
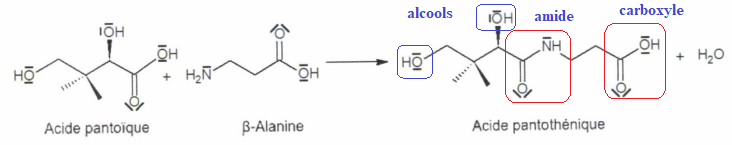 A.
A. La formule brute de l'acide pantoïque est C 6H 12O 4. Vrai.
B. La formule brute de l'acide pantoïque est C4H8O4. Faux.
C. L'acide pantothénique comporte une fonction amine. Faux.( fonction amide)D. L'acide pantothénique possède 3 fonctions alcools. Faux.( 2 fonctions alcool)
E. L'acide pantothénique possède 2 groupements carbonyles. Faux.
Exercice 6. 4 points.
Dosage conductimétrique du chlorure d'ammonium par une solution d'hydroxyde de sodium de concentration C b = 0,1 mol / L..
V a = 10 mL de solution de chlorure d'ammonium.
NH 4+aq + HO - aq --> NH 3aq + H 2O(l).
On obtient la courbe de titrage suivante :
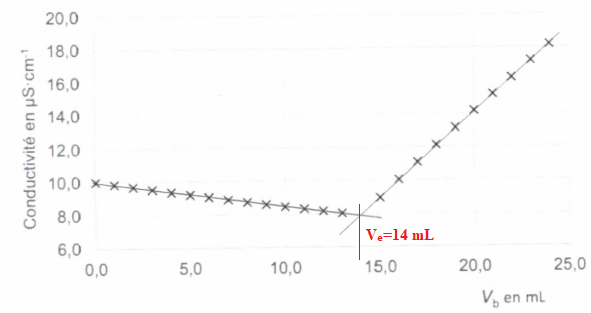 A.
A. La réaction support du dosage est une réaction acide base. Vrai.
Couples acide / base : H 2O(l) / HO -aq et NH 4+aq / NH 3aq.
B. La réaction support du dosage est une réaction d'oxydo-réduction. Faux.
C. La conductivité diminue avant l'équivalence car les ions hydroxydes sont consommés. Faux.
Avant l'équivalence, les ions HO- sont en défaut.
Du point de vue de la conductivité, on remplace des ions NH4+ par des ions Na+ de conductivité molaire ionique moindre.
D. Le volume équivalent vaut 15 mL. Faux.
E. La concentration de la solution de chlorure d'ammonium est Ca = 0,14 mol / L.
A l'équivalence Ca Va =Cb Ve ; Ca =Cb Ve/ Va =0,1 x14 / 10 = 0,14 mol / L. Vrai.
Chacun des graphes suivants reprèsentent l'évolution de la quantité de
matière d'une des espèces chimiques en fonction du volume versé de la
solution titrante d'hydroxyde de sodium.
QCM 7 à 11. Pour chaque figure indiquer de quelle espèce il s'agit ?
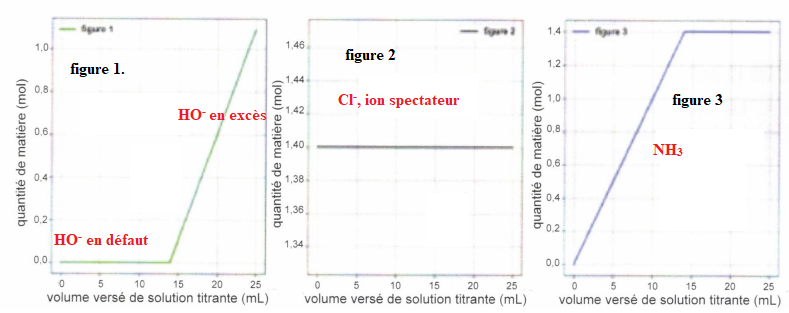
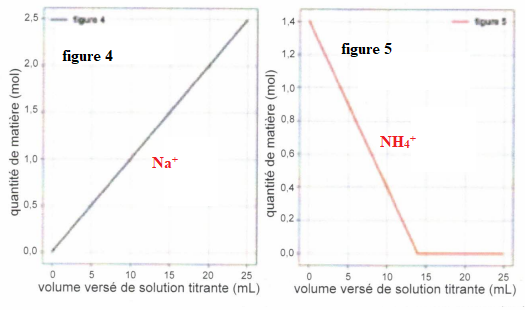
Exercice 7. 4 points.
Un vigneron suit la fermentation malolactique d'un vin contenu dans une cuve. L'acide malique est transformé en acide lactique.
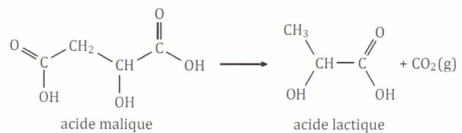
La température ambiante est de 15 °C. La concentration initiale en
acide malique dans le vin est de 3,0 g / L. La concentration en acide
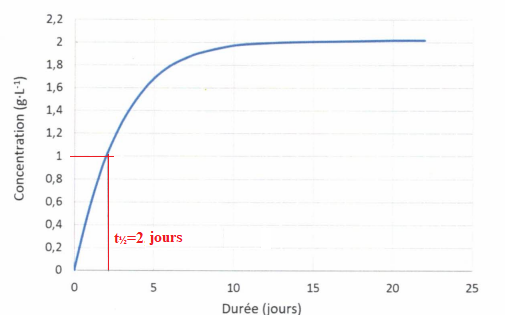
lactique au cours du temps est représentée sur le graphique suivant :
M(acide malique) = 12 x 4 + 6 + 16 x 5=134 g / mol.
3,0 g / L correspond à 3 /134 ~0,0223 mol / L.
M(acide lactique) = 12 x 3 + 6 + 16 x 3=90 g / mol.
On peut obtenir 0,0223 x90 = 2,0 g d'acide lactique si la réaction est totale.
QCM 12. A La fermentation malolactique est une réaction totale. Vrai.
B. La fermentation malolactique est une réaction limitée. Faux.C. le temps de demi-réaction est environ de 2 jours. Vrai.
D. le temps de demi-réaction est environ de 1 g / L. Faux.
E. Si la température ambiante est de 25°C, le temps de demi-réaction sera inférieur à celui obtenu à 15°C. Vrai.
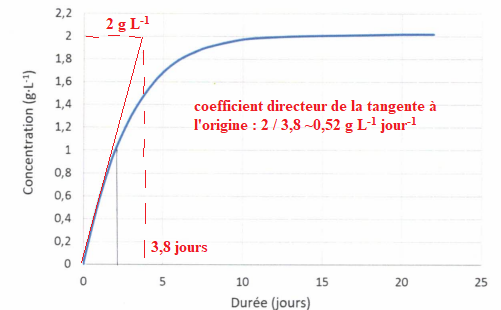
QCM 13. A. Si on ajoute un catalyseur le temps de demi-réaction sera plus long. Faux.
B.
Si on utilise une solution plus concentrée en acide malonique on va
modifier la concentration massique maximale obtenue en acide lactique. Vrai.
C.
Si on utilise une solution plus concentrée en acide malonique, la
concentration massique maximale en acide lactique sera inchangée. Faux.
D. La vitesse initiale de formation de l'acide lactique vaut environ 0,6 g L-1 jour-1. Vrai.
E. La vitesse initiale de formation de l'acide lactique vaut environ 1,6 g L-1 jour-1.
|
...
|
....
|
Exercice 8 (6 points).
Une pile met en jeu les couples Al3+ / Al et Cu2+ / Cu.
Al est oxydé et la pile débite un courant d'intensité I = 750 mA.
QCM 14 .
A. Une oxydation est une perte d'électron. Vrai.
Al = Al3+ + 3e-.
B. Une oxydation est un gain d'électron. Faux.
C. L'oxydation de Al s'écrit : Al = Al3+ + 3e-. Vrai.
D. L'oxydation de Al s'écrit : Al3+ + 3e-= Al Faux.
E. La borne positive est le cuivre. Vrai.
QCM 15.
A. Sur la borne positive la réaction qui s"y déroule est : Cu2+ + 2e- = Cu. Vrai.
B. Sur la borne négative, on a la réduction des ions Cu2+. Faux. ( oxydation de Al).
C. Le pont salin qui relie les deux demi-piles Al3+ / Al et Cu2+ / Cu permet le passage des électrons entre les compartiments. Faux.
Les électrons se déplacent dans les métaux.
D. L'équation bilan de la réaction traduisant le fonctionnement de la pile est Al + Cu2+ --> Al3+ + Cu. Faux.
2Al + 3Cu2+ --> 2Al3+ + 3Cu.
E. L'équation bilan de la réaction traduisant le fonctionnement de la pile est 2Al +3 Cu2+ --> 2Al3+ + 3Cu. Vrai.
QCM 16.
Lors de son fonctionnement, la quantité de matière d'ion aluminium formés vaut 7,5 10-2 mol.
A. Il va donc circuler 22,5 10-2 mol d'électrons. Vrai.
7,5 10-2 x3 =22,5 10-2 mol d'électrons.
B. Il va donc circuler 2,5 10-2 mol d'électrons. Faux.
C. La capacité de cette pile est 22500 C. Vrai.
Q =ne F = 22,5 10-2 x 96500 ~22 000 C.
D. La pile va fonctionner durant 16875 s. Faux.
Q / I = 22500 / 0,75 =30 000 s.
E. La pile va fonctionner durant 30 000 s. Vrai.
Exercice 9. 4 points.
Pour les adolescents , la dose journalière de caféine est fixée
à 3 mg par kilogramme de masse corporelle. On souhaite déterminer la
quantité de coca qu'un adolscent de 60 kg peut boire par jour. On
dispose d'une solution de caféine à 16 mg / L dont on fait le spectre.
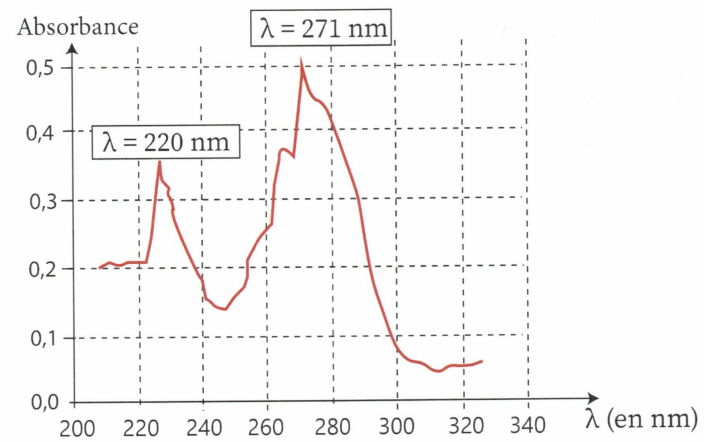
a. A quel dommaine appartiennent ces longueurs d'onde ?
Proche UV.
b. Rappeler la loi de Beer-Lambert.
A = e c L.
A : absorbance ; c : concentration mol/ L ; L : largeur de la cuve (cm).
e : coefficient d'extinction molaire L mol-1 cm-1.
c. Calculer la concentration molaire de la solution de caféine. M( caféine) =194 g / mol.
16 10-3 / 194 ~8,2 10-5 mol / L.
d. Le spectre a été réalisé dans une cuve de largeur 1 cm, calculer le coefficient d'extinction molaire à 271 nm.
A / c L = 0,5 /(8,2 10-5 x1) ~ 6 103 L mol-1 cm-1.
On se place à 271 nm et on mesure l'absorbance de 5 solutions de caféine.
On dilue 5 fois le coca et on mesure une absorbance A = 0,7.
e. Quelle est la concentration massique de la solution diluée de coca ?
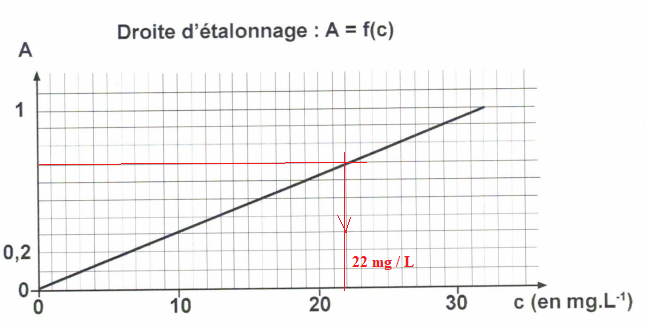
f. Quelle quantité de canettes de 33 cL un adolescent de 60 kg peut-il boire dans une journée sans dépasser la dose recommandée ?
Concentration de la solution non diluée : 5 x 22 = 110 mg / L.
Dose à ne pas dépasser : 60 x 3 = 180 mg / jour.
Volume de coca : 180 / 110 =1,64 L ou 1,64 / 0,33 ~5 canettes de 33 cL.
|
|