QCM,
hygiène et sécurité, electricité, optique, chimie,
concours adjoint technique Franche Comté 2013.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Exercice 1. Questions d'ordre général.
1. Les rayons X sont le mieux absorbés par lequel de ces matériaux ?
l'air, le bois, le plomb vrai.
2. H2SO4 est la formule :
d'un atome, d'une molécule, vrai, d'un ion.
3. Quel est l'instrument le plus précis pour effectuer une dilution ?
Une fiole jaugée, vrai, une éprouvette, un bécher.
4. Un Angström est une unité :
de volume, de vitesse, de longueur vrai.
5. On veut stocker 20 m3 d'eau dans un réservoir cylindrique de 2 m de diamètre sur 7 m de haut.
Le réservoir sera juste rempli. Vrai.
Le réservoir sera à moitié plein.
Le réservoir va déborder.
Volume d'un cylindre V = p R2h =3,14 x 12 x 7~22 m3.
6. A quoi sert un ampèremètre ?
A mesurer l'intensité du courant électrique vrai.
A mesurer la différence de potentiel entre deux bornes d'un circuit.
A meusrer l'énergie d'une lampe au sodium.
7. Ecrire la correspondance en puissance de 10.
micro : 10-6 ; nano : 10-9 ; kilo : 103 ; giga : 109.
8. Le sodium appartient à la famille des :
halogènes ; gaz rares ; alcalins, vrai.
9. Une eau est dite dure si elle contient beaucoup de :
carbonate de calcium vrai ; soude ; sel.
10. Un hygromètre permet de mesurer la vitesse du vent : faux.
Capteur de mesure d'humidité.
11. Deux isotopes ont le même :
nombre de charge ,vrai ; nombre de masse ; numéro atomique, vrai.
12. Une technique
couramment utilisée au laboratoire qui permet de séparer les espèces
chimiques contenus dans un liquide et de les identifier par comparaison
est :
chromatographie sur couche mince vrai ; distillation ; dosage conductimétrique.
13. Un appareil qui
permet de mesurer la température de fusion d'une espèce chimique et
ainsi à l'identifier à l'aide d'échantillon d'étalonnage est :
réfractomètre, banc Kofler vrai ; spectrophotomètre.
14. Un appareil qui permet de visualiser une tension alternative est :
un voltmètre numérique ; un ampèremètre analogique ; un oscilloscope vrai.
15. L'air contient en volume :
21 % d'O2 vrai ; 1 % d'O2 ; 78 % d'O2.
Exercice 2. Hygiène et sécurité.
Donner la définition des pictogrammes suivants :
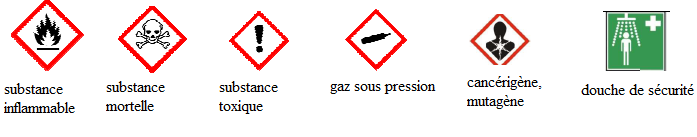
Exercice 3. Nomenclature.
Compléter les tableaux suivants :
Nom
|
formule
|
Nom
|
Formule
|
Carbone
|
C
|
Chlorure de fer III
|
FeCl3
|
Argent
|
Ag
|
nitrate de plomb
|
Pb(NO3)2
|
acide nitrique
|
HNO3
|
permanganate de potassium
|
KMnO4
|
acide éthanoïque ( acétique)
|
CH3COOH
|
éthanol
|
C2H5OH
|
Hydroxyde de potassium ou potasse
|
KOH
|
acétone ( propan-2-one)
|
CH3-CO-CH3
|
Nom
|
Formule
|
Nom
|
Formule
|
Ammonium
|
NH4+
|
Chlorure
|
Cl-
|
cation fer III
|
Fe3+
|
hydroxyde
|
HO-
|
plom II
|
Pb2+
|
iodure
|
I-
|
baryum
|
Ba2+
|
acétate ou éthanoate
|
CH3COO-
|
cation magnésium
|
Mg2+
|
sulfate
|
SO42-
|
Exercice 4. Commandes.
Le laborantin a besoin de faire une commande de petit matériel. Pour cela il créé un tableau. Le compléter.
Article
|
Quantité
|
Prix unitaire (HT) €
|
Prix HT €
|
béchers de 25 mL
|
20
|
2,75
|
55
|
spatules
|
12
|
3,40
|
40,8
|
fioles jaugées 500 mL
|
16
|
16,8
|
268,8
|
éprouvettes de 50 mL
|
8
|
9,65
|
77,20
|
büchner en porcelaine
|
12
|
46,90
|
562,8
|
|
|
Total HT
|
1004,6
|
|
|
Total TTC
TVA 19,6%
|
1004,6 x1,196
=1201,50
|
Exercice 5. Grandeurs et unités. Compléter le tableau.
Grandeur
|
Unité SI
|
Nom de l'unité
|
Grandeur
|
Unité SI
|
Nom de l'unité
|
longueur
|
m
|
mètre
|
Quantité de matière
|
mol
|
mole
|
fréquence
|
Hz
|
hertz
|
temps
|
s
|
seconde
|
quantité de chaleur
|
J
|
joule
|
volume
|
m3
|
mètre cube
|
puissance
|
W
|
watt
|
pression
|
Pa
|
pascal
|
force
|
N
|
newton
|
température
|
K
|
kelvin
|
.
|
...
|
....
|
Exercice 6. Tableau périodique.
1. Quel élément a le numéro atomique 3 ? lithium.
2. Quel numéro atomique porte l'étain ? Z =50.
3. Le premier gaz noble ( gaz rare ) est : hélium.
4. Quel élément a le symbole Cr ? Quelle est sa masse atomique ? Combien possède t-il d'électrons, de protons et de neutrons ?
chrome ; 51,991 g / mol ; 24 électrons, 24 protons et 52-24 =28 neutrons.
5. A quel groupe appartient l'iode ? Halogènes.
6. Donner les autres éléments de ce groupe.
Fluor, chlore, brome, astate.
7. Quand dit-on que deux atomes sont isotopes ? Donner un exemple.
Même numéro atomique, nombre de neutrons différents. 35Cl et 37Cl.
8. Quel est l'autre nom du tableau périodique ?
Tableau de Mendeleïev.
Exercice 7.
On dispose d'une solution de chlorure de sodium à 0,12 mol / L, notée S.
1. Quel volume V de solution S doit-on prélever pour réaliser 1,5 L de solution S1 de concentration 0,05 mol/L. Décrire les différentes étapes de cette manipulation.
Facteur de dilution F =0,12 / 0,05 = 2,4.
Volume de solution S à prélever : 1,5 / 2,4 =0,625 L.
Prélever 625 mL de S à l'aide d'une éprouvette graduée de 1000 mL.
Verser dans une fiole jaugée de 1,5 L.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
2. Quelle masse de NaCl doit-on dissoudre dans 300 mL de S pour que la concentration devienne 0,18 mol / L ?
M(Na) =22,90 g / mol ; M(Cl) = 35,45 g / mol. M(NaCl) =58,35 g / mol.
Final : 0,18 x 58,35 = 10,503 g dans 1 L ( 3,151 g NaCl dans 0,3 L).
Initial : 0,12 x 58,35 x0,3 =2,10 g.
3,151 -2,100 = 1,05 g.
Exercice 8.
Le laboratoire possède 1 litre de solution titrée d'acide chlorhydrique
à 1 mol / L. Vous devez fabriquer 0,5 L de solution d'acide
chlorhydrique à 0,01 mol/ L.
1. Comment appelle t-on cette manipulation ? Dilution.
2. Citer trois EPI que vous utilisez.
Blouse, lunettes et gants.
3. Quel matériel allez vous utiliser ?
Pipette jaugée 5,0 mL( facteur de dilution 100 ; volume solution mère : 0;500 / 100 = 0,005 L =5 mL).
Fiole jaugée 500 mL.
Propipette ; pisette eau distillée. Bécher 100 mL.
4. Quelle précaution doit-àn prendre ?
On doit verser l'acide dans l'eau.
Exercice 9. Montage en chimie organique.
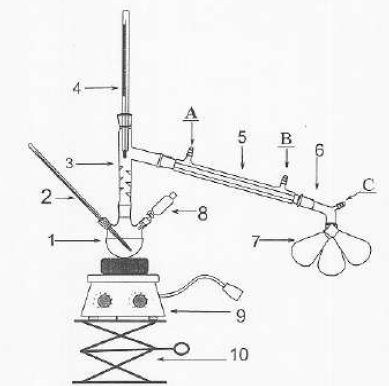
Identifier les différentes parties du montage.
1 : ballon tricol ; 2 : thermomètre bouilleur ; 3 : colonne Vigreux ; 4 : thermomètre vapeurs;
5 : réfrigérant à eau ; 6 : allonge coudée ; 7 : séparateur de
Pauly (pi de vache) ; 8 : ampoule de coulée ; 9 : chauffe ballon ; 10 :
élévateur à croisillons ;
A quoi sert ce montage ?
Distillation fractionnée sous pression réduite..
Quel est le rôle des éléments A, B et C ?
A : sortie de l'eau ; B arrivée de l'eau ; C permet le raccord avec le vide.
Exercice 10.
Donner le nom de l'appareil.
pHmètre.
Donner le nom des solutions pour l'étalonner.
Solutions tampon s pH =4 et pH = 7.
Comment doit-on conserver les électrodes ?
Solution de KCl.
Quelle grandeur mesure t-il ? Quelle échelle est utilisée ?
Mesure du pH ; échelle 0 - 14.
Si vous ne possédez pas cet appareil, quel moyen simple utilisez-vous
pour déterminer approximativement la grandeur qu'il mesure ?
Papier indicateur universel pH.
On se propose de déterminer la concentration molaire d'une solution de
soude que l'on vient de préparer par une solution de HCl titrée à 0,1
mol/L. Où place t-on la solution de soude ?
Dans le bécher ou l'erlenmeyer.
Où place t-on 'acide chlorhydrique ?
Dans la burette graduée.
La courbe ci-dessous est obtenue. Repérer le point équivalent E
Donner la concentration molaire de NaOH : VNaOH = 10 mL.
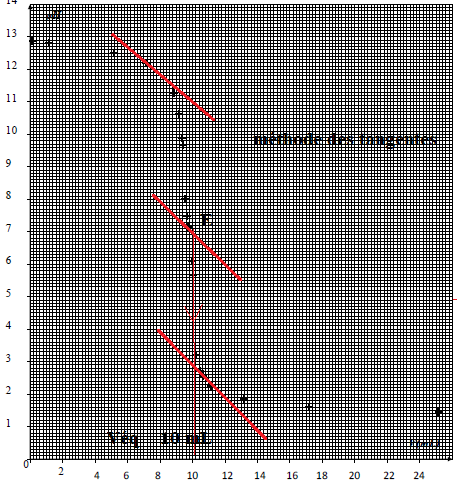
A l'équivalence C NaOH V NaOH = CHCl Véqui ; C NaOH = 0,10 x10 / 10 = 0,10 mol/ L.
11. Détermination de la raideur d'un ressort.
On enregistre les oscillations d'un pendule élastique formé d'un ressort de raideur k de masse m0 et chargé d'une masse m = 100 g avec m0 << m.
On obtient le graphe ci-dessous.
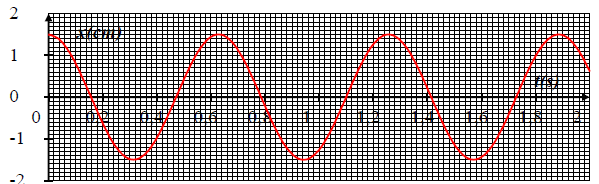
Quelle est la forme de la courbe ? Sinusoïde.
Déterminer graphiquement T. T = 0,6 s.
T = 2 p (m / k)½. En déduire k.
k = 4 p2 m / T2 =4 x3,142 x0,100 / 0,62 =10,97 ~11 N m-1.
12. Indiquer la représentation schématique d'une lentille mince convergente et d'une lentille mince divergente.
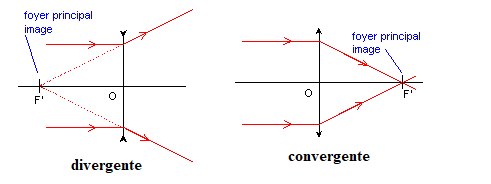
Comment distingue t-on rapidement ces deux types de lentilles ?
La lentille convergente a des bords plus minces que le centre. La lentille divergente a des bords plus épais que le centre.
Sur la monture d'une lentille on lit +5 d, de quel type de lentille s'agit-il ? Que signifie 5 d ?
La vergnece 5 d est positive, la lentille est convergente.
Quelle est la distance focale de cette lentille ? Citer une méthode
pratique pour déterminer la distance focale de cette lentille.
f = 1 / 5 = 0,2 m.
Former sur un écran l'image d'un objet situé à plus de deux mètres de
la lentille. La distance lentille-écran est égale à la distance focale.
Décomposition de la lumière blanche.
Faire un schéma en indiquant la couleur la moins déviée par le prisme.
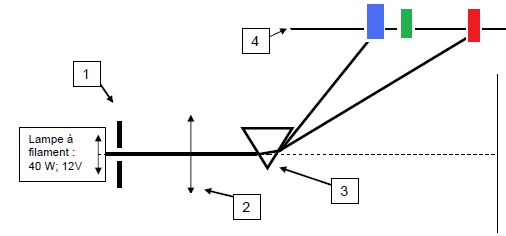
Le rouge est le moins dévié.
Comment recomposer la lumière blanche préalablement décomposée par un prisme ?
On peu utiliser un seccond prisme.
13. Donner le nom de chaque symbole.
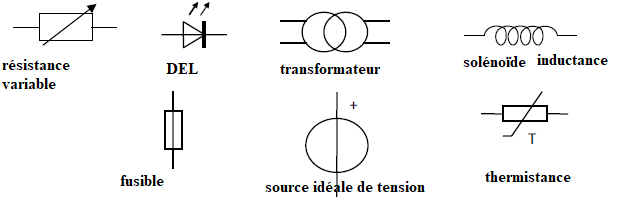
14. Compléter le schéma en reliant les connexions entre le circuit et
l'oscilloscope pour visualiser sur la voie 1 la tension délivrée par le
GBF et sur la voie 2 la tension aux bornes de R.
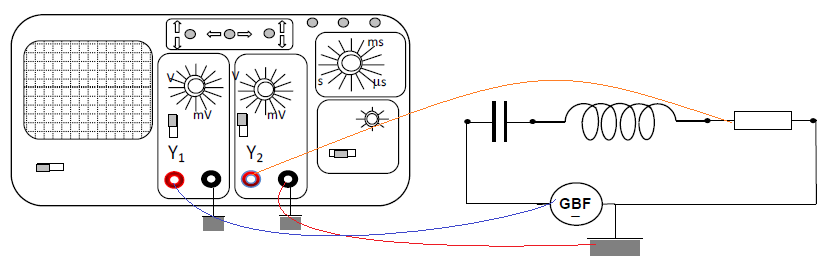
On obtient les courbes suivantes.
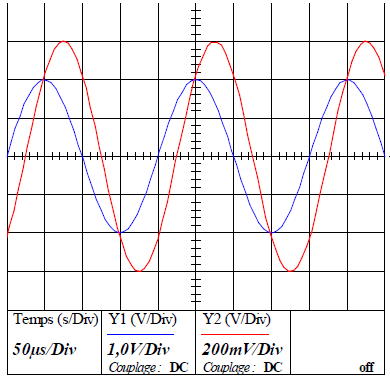
Quelle est la fréquence ?
période T : 4 divisions soit 200 µs = 2 10-4 s : fréquence f = 1 / (2 10-4) = 5000 Hz = 5 kHz.
Trouver la tension maximale délivrée par le GBF.
Voie 1 : 2 divisions soit U = 2 V.
Donner l'intensité maximale du courant si R = 50 ohms.
Tension maximale aux bornes de la résistance : 3 divisions soit 600 mV = 0,6 V.
Intensité maximale : 0,6 / 50 =0,012 A.
Pourquoi Ue mesurée par le voltmètre branché en dérivation aux bornes du GBF affiche U = 1,41 V ?
Le voltmètre indique la tension efficace. Ueff = Umax / 1,4 =1,41 V.
On branche un voltmètre directement aux bornes du GBF, indiquer le choix AC ou DC du réglage et son calibre.
Choix AC, calibre 2 V.
|
|









