Concours
technicien-ne en chimie et sciences physiques, Dijon 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Chimie générale. 30 points.
1 :
Sachant que les densités du dichlorométhane et du mercure sont respectivement
1,33 et 13,56, quel volume de dichlorométhane présente la même masse que 25
mL de mercure ?
Masse de 25 mL de mercure : 25 x13,56 =339 g.
Volume de 339 g de dichlorométhane : 339 / 1,33 ~255 mL.
2.
On souhaite déterminer la teneur en métal d’un minerai de plomb. Pour ce faire,
un échantillon de minerai, de masse égale à 100 g, est attaqué, mis à sec et
dissous dans de l’eau, après quoi on ajoute à la solution du sulfate de sodium
(Na2SO4) en excès afin de faire précipiter le sulfate de plomb II. On obtient 25,46
g de précipité.
a) Écrivez la réaction de précipitation.
Pb2+aq + SO42-aq --> PbSO4(s).
b) Quel est le pourcentage massique de plomb dans le minerai initial ?
M(PbSO4)=207,2 +32 +4x16 =303,2 g/mol.
n = m / M = 25,46 / 303,2 =0,084 mol.
Masse de plomb : 0,084 x 207,2 =17,4 g dans 100 g ( 17,4 %).
3. En vous aidant de la classification périodique des éléments en Annexe 1 :
a) Donnez trois ions isoélectroniques de F-
.
O2-; N3-; C4- ont le même nombre délectrons que F-.
b) Donnez les configurations électroniques complètes de l’arsenic As, du calcium
Ca, du chrome Cr et du phosphore P.
33As : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3.
20Ca : 1s2 2s2 2p6 3s2 3p6 4s2 .
24Cr : 1s2 2s2 2p6 3s2 3p6 3d5 4s1 .
15P : 1s2 2s2 2p6 3s2 3p3 .
c) Déterminez les nombres d’oxydations (ou degré d'oxydation) des éléments
dans les composés suivants :
H2O : H (I) ; O(-II) ; HCl : H (I) ; Cl(-I) ; ClO4
- : O(-II) ; Cl(VII) ; Cl2O ; O(-II) ; Cl(I)
SO3
2-
: O(-II) ; S(IV) ; SO2Cl2 : Cl(-I) ; O(-II) ; S (VI) ; CrO4
2-
: O(-II) ; Cr(VI) ;
PH3 H(I) ; P(-III) ; P2H4 H(I) ; P(-II)
4. Écrivez les équations des réactions redox à l’équilibre ayant lieu entre :
a) Les ions argent Ag+
(aq) et le cuivre métallique Cu(s).
2Ag+aq +Cus) -->2Ag(s) + Cu2+aq.
b) Les ions iodure I-
(aq) et les ions peroxodisulfate S2O8
2-
(aq).
2I-
(aq) +S2O8
2-
(aq) --> I2aq + 2SO42-aq.
c) Les ions dichromate Cr2O7
2-
(aq) et les ions iodure I-
(aq) à pH = 0.
Cr2O7
2-
(aq) +6I-
(aq) +14H+aq -->2Cr3+aq +3I2aq + 7H2O(l)
d) Les ions nitrate NO3
-
(aq) et le cuivre métallique Cu(s) à pH = 0.
NO3
-
(aq) + Cu(s) +3H+aq --> Cu2+aq + HNO2 aq+ H2O(l).
e) Les ions iodate IO3
-
(aq) et les ions iodure I-
(aq) à pH = 0.
IO3
-
(aq) +5 I-
(aq)+6H+aq -->3I2
(aq)+3H2O(l).
Chimie organique (30 points).
I. L’articaïne, anesthésique local utilisé en odontologie, est représentée ci-dessous.
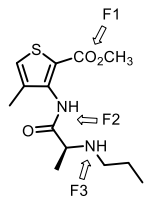 1. Donner le nom des fonctions chimiques F1, F2 et F3.
1. Donner le nom des fonctions chimiques F1, F2 et F3.
F1 : ester ; F2 : amide ; F3 amine secondaire.
2. Donner le nombre d'atomes de carbone hybridés sp2
.
Quatre : 2 liaisons C=O et deux liaisons C=C..
3. En utilisant la théorie V.S.E.P.R prévoir la géométrie de l’atome de carbone de
la fonction F2.
Triangulaire plan, type AX3.
4. Sur la formule de l’articaïne, indiquer par un * l’atome de carbone asymétrique
et indiquer sa configuration absolue.
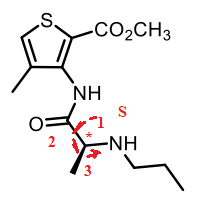 5. Sur la formule de l’articaïne, indiquer la configuration absolue des deux doubles
liaisons C=C.
5. Sur la formule de l’articaïne, indiquer la configuration absolue des deux doubles
liaisons C=C.
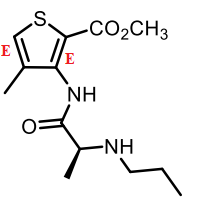
II :
1. A quelle catégorie de réactifs appartiennent les réactifs suivants : électrophile,
nucléophile, acide, oxydant…
CH3COCH3 :
2 doublets non liants sur l'atome d'oxygène, donc nucléophile.
EtNH2 : un doublet non liants sur l'atome d'azote, donc nucléophile.
H3PO4 : acide.
NaBH4 : réducteur.
MeONa : base forte
KMnO4 : oxydant.
2. A quelle classe de réactions appartiennent les transformations suivantes :
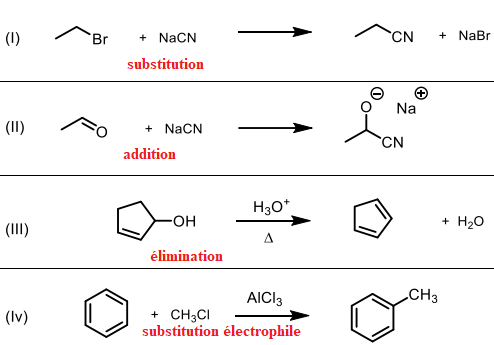
3. En s’appuyant sur les notions de pKa, identifier les produits éventuellement formés
dans chacune des réactions suivantes ?
CH3COOH + CH3COONa ( acide faible et sa base conjuguée, pas de réaction ).
CH3COONa +CH3(CH2)2 CH3.
CH3CH2MgBr + H2O -->CH3CH3 + ½Mg(OH)2 + ½MgBr2.
CH3CH2CH2CH2Li + CH3CH2OH --> CH3CH2O- +Li+ +CH3CH2CH2CH3
4.
1. Qu’est-ce qu’un hydrocarbure ? Donner deux exemples d’hydrocarbures
Un hydrocarbure est composé uniquement de carbone et d'hydrogène.
CH4 ; C6H6.
2. Donner la définition d’une molécule chirale.
Une molécule chirale n'est pas superposable à son image dans un miroir.
3. Donner la définition d’un acide de Brönsted / d’un acide de Lewis
Un acide de Brônsted est susceptible de céder un proton H+.
Un acide de Lewis possède une lacune électronique. Il est susceptible d'accepter un doublet d'électrons.
4. Donner les conditions nécessaires pour qu’un composé organique soit
aromatique.
Monocylclique plan possédant 4 n+2 électrons délocalisables.
III. Préparation du 1,4-dichlorométhoxybenzène 30 points.
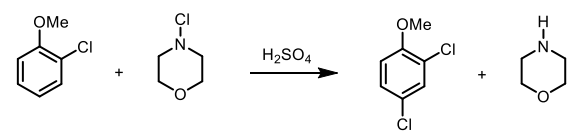
1. Traduire le mode opératoire.
2. Identifier les 3 étapes de la synthèse : « réaction », « isolement » et «
purification ».
Réaction. Dans un ballon bicol refroidit dans un bain de glace, on introduit 250 mL H2SO4
8 M et 16 g de 2-chlorométhoxybenzène sous agitation. On ajoute goutte
à goutte 14,5 g de Nchloromorpholine. On retire le bain de
refroidissement et l'agitation est poursuivie pendant une heure.
Isolement.
Le mélange réactionnel est versé dans un mélange de 150 mL d'eau
distillée et 100 g de glace pillée dans un ballon de 1 L. Les produits
sont extraits avec une portion de 100 mL suivie de 4 portions de 50 mL
d'éther éthylique. Les extraits éthérés sont lavés avec 100 mL d'eau et
séchés sur MgSO4 anhydre et concentré à l'évaporateur rotatif.
Purification. Le
concentré ( 17,1 g) est distillé sous pression réduite pour donner 15,2
g de 2,4-dichlorométhoxybenzène, poinr d'ébullition 110 °C.
3. Calculer
le nombre de moles des réactifs et des produits de la réaction. Quel est le réactif
limitant ?
2-chlorométhoxybenzène : C7 H7OCl: M =142,5 g / mol ; n = 16 / 142,5 =0,112 mol.
Nchloromorpholine : C4H8ONCl ; M =121,5 g / mol ; n =14,5 /121,5=0,119 mol ( en excès)
Produit : C7H6OCl2 ; M = 177 g / mol ; nthéorique =0,112 mol ou 19,8 g.
4. Calculer les rendements en produit brut et en produit pur de la réaction ainsi que
le rendement de la distillation.
Produit brut : 17,1 / 19,8=0,86.
Produit pur : 15,2 / 19,8 =0,77.
5. Pourquoi la distillation est-elle effectuée sous pression réduite ?
La température d'ébullition sous 1 bar est trop élevée (236 °C).
6. Calculer le nombre de moles de H2SO4 placé dans le ballon.
0,25 x8 =2 mol.
7. Pourquoi faut-il verser avec précaution le mélange réactionnel dans le mélange
eau-glace ?
Pour éviter les projections d'acide sulfurique.
|
...
|
....
|
Analyse chimique . 30 points
On vous demande de déterminer la structure d’une molécule A à l’aide des analyses
qui ont été effectuées.
1) L’analyse par spectrométrie de masse par impact électronique conduit au
spectre suivant :
m /z
|
39
|
65
|
93
|
121
|
152
|
intensité relative %
|
17
|
23
|
25
|
100
|
35
|
a) Que signifie le rapport m/z ?
masse / charge.
b) Que pouvez-vous en déduire sur la masse moléculaire de A ?
M= 152 g /mol.
2. L’analyse centésimale de A est la suivante :
C = 63,15 % ; H = 5,26 % ; O = 31,57 %
Déduisez-en, en utilisant la réponse à la question 1) b), la formule brute de A.
Formule brute : CxHyOz.
12 x / 63,15 = y / 5,26 = 16z / 31,57 = M /100=1,52.
x=1,52 x63,15 /12 ~8.
y =1,52 x5,26 ~8.
z = 1,52 x 31,57 / 16 ~3
C8H8O3.
3) L’analyse par spectrométrie RMN 1H et 13C permet d’observer les pics
suivants :
1H
déplacement chimique (ppm)
|
3,90
|
6,67
|
6,89
|
7,95
|
multiplicité
|
singulet
|
singulet large
|
doublet
|
doublet
|
intégration
|
3H
|
1H
|
2H
|
2H
|
13C
Déplacements chimiques (ppm) : 51,5 ; 115,8 ; 122,7 ; 131,3 ; 162,8 ; 165,9
a) D’après le spectre 1H, pensez-vous que A puisse comporter un groupement
éthyle (CH2-CH3) ? Justifiez votre réponse.
Non. On n'observe pas la multiplicité suivante : triplet vers 1 ppm et quadruplet vers 2 ppm.
.b) Sachant que le spectre 1H a été mesuré à une fréquence de 500 MHz,
convertissez les valeurs des déplacements chimiques, données en ppm, en
Hertz.
1 ppm = 500 Hz.
3,90 x500 =1950 Hz ; 6,67 x500 =3335 Hz ; 6,89 x500 =3445 Hz ; 7,95 x500 =3975 Hz.
c) Le spectre 13C comprend 6 pics. Comparez cette valeur avec le nombre de
carbones dans la molécule A. Que pouvez-vous en déduire ?
Certains carbone sont équivalents.
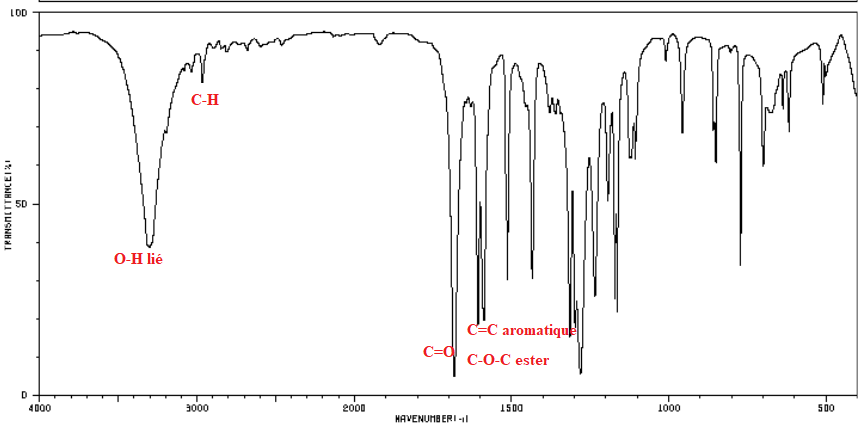
4. L’analyse par spectrométrie IR conduit au spectre suivant :
a) Comment procéderiez-vous pour effectuer cette analyse si A est un liquide ?
Un solide ?
Solide (échantillon mélangé avec KBr), liquide ( placé entre deux plaque d'un sel très pur NaCl).
b) On peut noter dans ce spectre des bandes caractéristiques à 1600, 1700,
2850 et 3400 cm-1
. Déterminez à quelles
fonctions chimiques ces bandes pourraient correspondre.
5) Déduisez de l’ensemble des informations récoltées laquelle des trois
structures suivantes correspond à A et nommez-la.
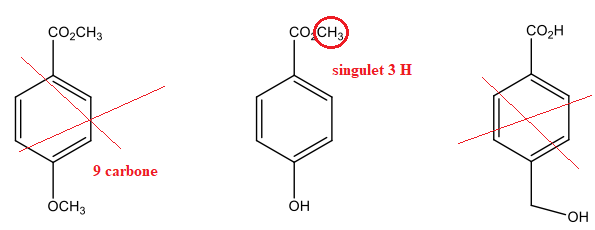
4-hydroxybenzoate de méthyle.
Hygiène et sécurité.
1. Que signifient les indications portées sur l’étiquette du DMF ?
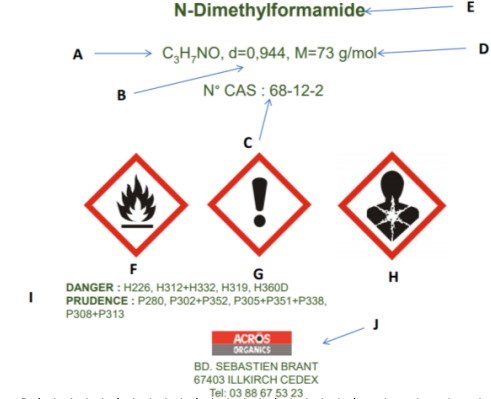
A : formule brute; B : densité ; C : numéro CAS ; D : masse molaire ; E : nom (nomenclature officielle)
F : inflammable ; G : danger ; H : CMR ; I : indications de danger et moyens de protection.; J : identification du distributeur.
2. Une jeune étudiante souhaite utiliser le DMF que vous avez commandé. Quels
équipements de protection individuel (EPI) doit-elle porter ?
Port de blouse, gants, lunettes ; travail sous hotte aspirante loin de toutes flammes ou source de chaleur
.
Stockage et Gestion des déchets.
Peut-on stocker sans risque dans les mêmes bacs de rétention les composés
suivants.
Dichlorométhane et acétate d'éthyle : oui.
Acide chlorhydrique 37 % et hydroxyde de sodium : non ( réaction acide base exothermique).
Hydrure de sodium et solution saturée en NaCl : non NaH réagit viollement avec l'eau.
Acétone et acide nitrique : non, l'acide nitrique étant un oxydant fort.
Ethanol et éther diéthylique. Oui.
Acide sulfurique 95 % et eau déminéralisée :oui
Solution de carbonate de sodium 1 M et solution d'hydroxyde de potassium 1 M : oui.
Dans quel bidon de récupération peut-on jeter les déchets suivants :
Acide sulfurique dilué : bidon noté "acide"
Silice : bidon noté "déchets solides".
Ether diéthylique : bidon noté solvant non halogéné".
Dichlorométhane : bidon noté " solvant halogéné".
Sulfate de magnésium : bidon noté " base et sels minéraux".
Méthanol : bidon noté "solvant non halogénés".
Solution carbonate de sodium : bidon noté " base et sels minéraux".
olution de soude : bidon noté " base et sels minéraux".
: Risque incendie.
Dans le laboratoire où vous manipulez, vous disposez de 2 types d’extincteurs : un
extincteur à eau (+ additif) et un extincteur à CO2. Lequel utiliseriez-vous pour
éteindre :
- Un feu d’origine électrique :
- Un feu de solvant
organique :
- Un feu de papier :
Quel autre type d’extincteur connaissez-vous ?
Les
feux sont classés en 4 classes: A : feux de solides ; B : feux de
liquides ; C : feux de gaz ; D : feux de métaux. On y ajoute les feux
d'origine électrique E.
sable ( feu de métaux type D) ; seaux d'eau ( feu de solide type A ); extincteur à eau avec additifs (feux de liquides type B) ; extincteur à CO2 ( feu d'origine électrique) ; extincteur à poudre ( feu de gaz).
Commandes.
Vous devez commander auprès du fournisseur Labo GreenChem les articles
suivants :
25 boîtes de pipettes Pasteur
8 boîtes de seringues de 1 mL
(250 unités par boïte ; 32,15 € )
15 boîtes de seringues de 5 mL
(100 unités par boïte ; 14,40 € )
12 boîtes de seringues de 10 mL
(100 unités par boïte ; 27,90 € )
Et suffisamment d’aiguilles pour les seringues commandées.
144 Aiguilles par boïte ; 2,60 €.
Pipettes Pasteur 250 unités par boïtes 6,84 €.
Pour avoir suffisamment d’aiguilles pour toutes les seringues, combien de boîtes
d’aiguilles devez-vous commander ?
250 x8 = 2000 seringues de 1 mL.
15 x100 = 1500 seringues de 5 mL.
12 x100 = 1200 seringues de 10 mL.
Total 4700 seringues soit 4700 / 144 ~33 boïtes d'aiguilles.
Lorsque vous commandez plus de 10 unités d’une référence, le fournisseur vous fait
une réduction de 10% sur l’article. Calculez le montant de la commande ? Vous
détaillerez vos calculs pour chaque article.
Pipettes Pasteur
25 x 6,84 x 0,90 =153,9 €.
Seringues 1 mL : 8 x 32,15 =257,2 €.
Seringues 5 mL : 15 x 14,40 x 0,90 =194,4 €.
Seringues 10 mL : 12 x 27,90 x 0,90 =301,32 €.
Aiguilles : 33 x 2,60 x0,90 =77,22 €.
Total : 984,04 €.
Sachant que la TVA appliquée est de 20%, calculez-le montant TTC de votre
commande ?
984,04 x 1,20=1180,85 €.
|
|