Chimie
générale, concours TSPEI 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Les molécules.
I. Techniques d'analyse.
Identifier les constituants d'un mélange par CCM.
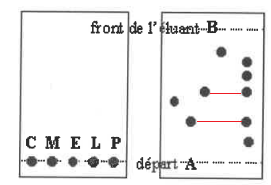
C : citral ; M : menthol ; E : eucalyptol ; L : limonène ; P : produit à analyser.
1. Quel est le principe de la technique ?
But : séparer et identifier les constituants d'un mélange.
Mise en oeuvre : placer l'éluant dans le bécher ( hauteur 5 mm), mettre un couvercle.
Sur la plaque CCM, tracer 2 traits au crayon de papier à 7 ou 8 mm des extrémités.
Sur le trait inférieur faire les dépots (pipette pasteur), espèces à analyser et substances étalon.
Placer la plaque dans le bécher, fermer, retirer dés que l'éluant atteint le trait supérieur.
2. Faut-il que le niveau de l'éluant dans le récipient utilisé soit plus élevé ue la ligne A ? Pourquoi ?
Non. L'éluant migre par capillarité et entraîne les composés.
3. Le mélange ne contient pas de citral. Pourquoi ?
Dans le mélange P, sur la plaque après élution, on observe 5 taches.
Aucune ne correspond au rapport frontal de l'étalon citral.
4. Le produit est un mélange d'au moins 5 corps différents. Pourquoi ?
Dans le mélange P, sur la plaque après élution, on observe 5 taches situées à des hauteurs différentes.
2. Calcul d'incertitudes.
La composition molaire d'un mélange binaire est définie par :x1 = n1 /(n1+n2). La préparation du mélange est effectuée par pesée. On désigne par m1 et m2 les masses des composés 1 et 2. La précision de la balance est ± a.
Déterminer l'incertitude u(x1) en fonction de la précision de la balance.
u(x1) = x1 [ (a / m1)2 + (a / m2)2]½.
3. Structures moléculaires.
1. Soit
l'azote 168O. Combien l'atome comporte-t-il
d'électrons ? De neutrons ?
Identifier ces plus proches voisins. Donner sa structure électronique
et son schéma de Lewis.
8 électrons ; 8 protons ; 16-8 = 8 neutrons.
Structure électronique : 1 s2 2s2 2p4.
Ces plus proches voisins sont le fluor, l'azote et le soufre.
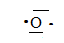
2. Soit
l'azote 136C. Combien l'atome comporte-t-il
d'électrons ? De neutrons ?
Identifier ces plus proches voisins. Donner sa structure électronique
et son schéma de Lewis.
6 électrons ; 6 protons et 13-6= 7 neutrons.
Ces plus proches voisins sont le bore, l'azote et le silicium..
Structure électronique : 1 s2 2s2 2p2.
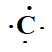
3. Donner la structure du dioxyde de carbone. Justifier.
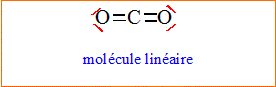 L'atome
de
carbone central est du type AX2.
4 Atomistique. L'atome
de
carbone central est du type AX2.
4 Atomistique.
Le dioxyde de carbone est un gaz à 20°C sous 1,013 bar.
1. Quel est le volume molaire ?
Equation des gaz parfaits : PV = nRT.
Vm = RT / P = 8,314 x(273+20) / (1,013 105)=0,0240 m3 /mol = 24,0 L /mol.
2. Quelle est la distance moyenne entre les molécules de dioxyde de carbone.
Les molécules sont supposées ponctuelles. les distances entre elles sont de centre à centre de deux molécules.
Nombre de molécules dans 0,024 m3 : N =NA = 6,024 1023 molécules.
Densité volumique : N / V =6,024 1023/ 0,024 =2,50 1025 molécules.
Le volume occupé par une molécule est celui d'un cube de côté d, de volume d3.
N d3 = V ; d3 =V / N =1 /(2,5 1025)~ 4 10-26. d ~3,4 10-9 m = 3,4 nm.
5. Diagramme de phases du dioxyde de carbone.
Température critique Tc =304,13 K ; pression critique : 73,773 bar ; température du point triple : 216,59 K ;
température d'ébullition 194,69 K.
5.1 Etude des pressions de vapeurs saturantes.
T(K)
|
298
|
293
|
273
|
263
|
253
|
243
|
233
|
223
|
220
|
P(MPa)
|
6,4121
|
5,7089
|
3,4713
|
2,6374
|
1,9605
|
1,4206
|
0,99896
|
0,67819
|
0,59913
|
ln(P)
|
1,858
|
1,742
|
1,245
|
0,970
|
0,673
|
0,351
|
-0,0010
|
-0,389
|
-0,512
|
1 / T
|
3,36 10-3
|
3,4110-3 |
3,6610-3 |
3,8010-3 |
0,395 10-3 |
4,12 10-3 |
4,2910-3 |
4,48 10-3 |
4,55 10-3 |
A partir d'ue loi du type ln(P) = A + B / T,
déterminer A et B. Quelle est la valeur de la pression à la température
du point triple. Conclure.
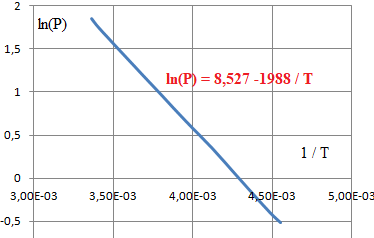
Au point triple : lnP = 8,257 -1988 / 216,59 =-0,921 ; P =0,398 MPa.
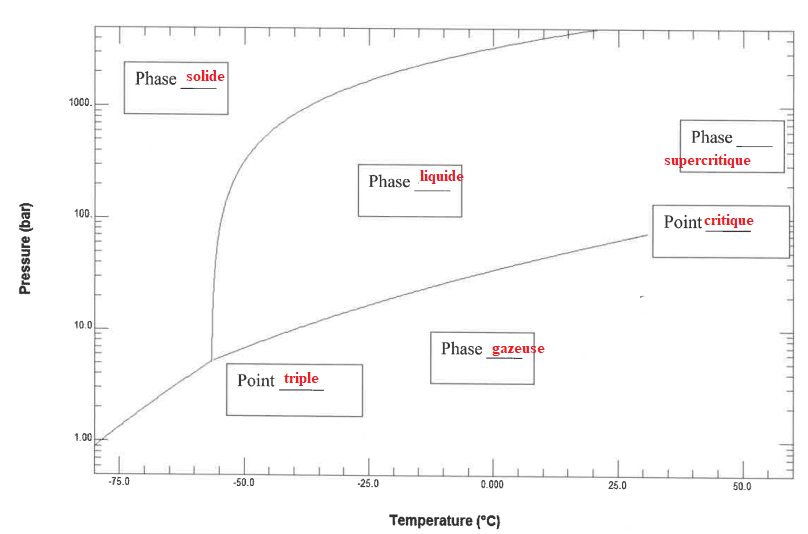
5.2 Tracer le diagramme des phases du dioxyde de carbone. Identifier les phases.
Comment s'appelle la transition solide vapeur ? Sublimation.
Chimie organique.
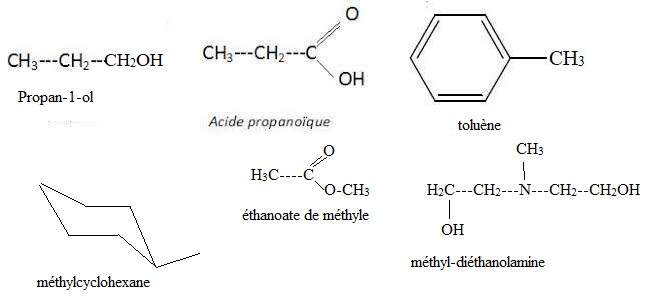
1. Donner les formules semi-développées de :
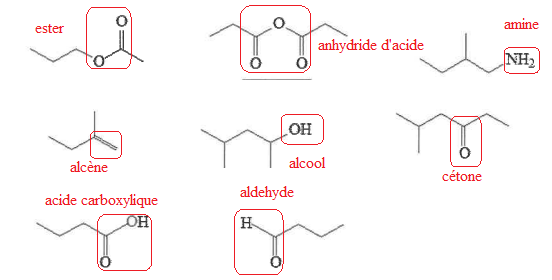
2. Identifier et nommer les fonctions chimiques :
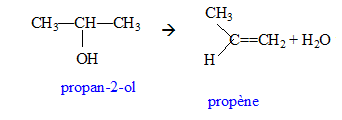
3. Qu'obtient-on par déshydratation intermoléculaire du propan-2-ol.
On obtient du propène et de l'eau.
|
...
|
....
|
Chimie des solutions aqueuses.
1. L'acide acétique.
Le pH mesuré d'une solution à 0,01 mol/L est égal à 3,35.
1. Donner la définition d'un acide selon Brönsted.
Espèce, ion ou molécule, susceptible de céder un proton H+.
2. Ecrire l'équation de la réaction de l'acide acétique avec l'eau et en déduire la constante d'acidité Ka.
CH3-COOH aq+ H2O(l) = CH3COO- aq+H3O+aq.
Ka = [CH3COO- aq][H3O+aq] / [CH3-COOH aq]
Ka = [H3O+aq]2 / [CH3-COOH aq] ~ [H3O+aq]2 / c.
Ka ~ 10-3,35x 10-3,35 / 0,01 ~2 10-5.
2. Diagramme de Pourbaix du fer. La concentration est 0,01 mol/L.
1. Quels sont les nombres d'oxydation des différentes espèces ? Compléter la figure.
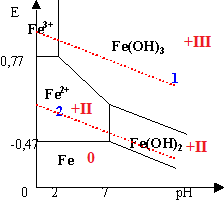
2. Ecrire toutes les réactions redox et les réactions de précipitation.
Fe(s) = Fe2+aq +2e-.E° = -0,44 V.
Fe(s) = Fe3+aq +3e-.
Fe2+aq = Fe3+aq +e-. E° = 0,77 V.
Fe(s) + 2HO-aq = Fe(OH)2 s +2e-
Fe2+aq + 2HO-aq = Fe(OH)2 s.
Fe2+aq +3HO-aq= Fe(OH)3 s +e-..
Fe(OH)2 s +HO-aq =Fe(OH)3 s +e-..
3. Déterminer les pH d'apparition des précipités.
prédominance
des ions et des hydroxydes
pH d'apparition de
Fe(OH)3 :
dans sa zône de
prédominance
[Fe3+]=0,01 ;
l'hydroxyde apparaît dès
que :
[Fe3+][OH-]3=10-37,53. [OH-]3=10-35,53. [OH- ]=10-11,84.
pH=14-11,84~2,16
pH d'apparition de
Fe(OH)2 :
dans sa zône de
prédominance
[Fe2+]=0,01 ;
l'hydroxyde apparaît dès
que :
[Fe2+][OH-]2=10-15,26. [OH-]2=10-13,26. [OH- ]=10-6,63.
pH=14-6,63~7,37.
4. Déterminer les potentiels redox de référence des demi-réactions redox impliquant les précipités.
Fe(s) = Fe2+aq +2e-.E° = -0,44 V. E1 =-0,44 +0,03 log
[Fe2+aq].
Fe2+aq + 2HO-aq = Fe(OH)2 s.
[Fe2+aq].[HO-aq]2 = 10-15,26.
E1 =-0,44 +0,03 log( 10-15,26/ [HO-aq]2).
E1 =-0,44 -0,03 x15,26 + log( 1/ [HO-aq]2).
Fe(s) + 2HO-aq = Fe(OH)2 s +2e-.
E1 =E°( Fe(OH)2 s/ Fe(s))+0,03 log (1/[HO-aq]2)
1/[HO-aq] = [H3O+aq] / 10-14. 0,03 log (1/[HO-aq]2)= -0,06 pH +0,84.
E°( Fe(OH)2 s/ Fe(s)) ~ -0,06.
Fe2+aq = Fe3+aq +e-. E° = 0,77 V. E2 =0,77 +0,03 log ([Fe3+aq] /
[Fe2+aq]).
Fe3+aq + 3HO-aq = Fe(OH)3 s.
[Fe3+aq].[HO-aq]3 = 10-37,53.
[Fe2+aq].[HO-aq]2 = 10-15,26.
[Fe3+aq] /
[Fe2+aq]=10-22,27. / [HO-aq]
E2 =0,77 +0,06 log( 10-22,27/ [HO-aq]).
E2 =0,77 -0,06 x22,27 + log( 1/ [HO-aq])= -0,566 + log( 1/ [HO-aq])
Fe(OH)2 s + HO-aq = Fe(OH)3 s +e-.
E2 =E°( Fe(OH)3 s/ Fe(OH)2 s)+0,06 log (1/[HO-aq])
1/[HO-aq] = [H3O+aq] / 10-14. 0,06 log (1/[HO-aq])= -0,06 pH +0,84.
E°( Fe(OH)3 s/ Fe(OH)2 s) ~ 0,274.
Thermochimie. Réaction de craquage du propane.
1. Ecrire l'équation de la réaction et construire un tableau d'avancement.
2. En déduire l'expression de la constante d'équilibre en fonction du taux d'avancement à l'équilibre
C3H8 --> C3H6 + H2. DrG°=86,2 J / mol. P = 1 bar. T = 298 K.
|
avancement mol
|
C3H8 |
--> C3H6 |
+ H2 |
initial
|
0
|
n
|
0
|
0
|
en cours
|
x
|
n-x
|
x
|
x
|
final
|
xf
|
n-xf
|
xf |
xf |
Taux d'avancement final : t = xf / xmax = xf / n.
Fractions molaires : xH2 = xC3H6= xf / (n+xf) ; xC3H8=( n-xf ) / (n+xf) .
Pressions partielles : PH2 = PC3H6= xf / (n+xf)P ; PC3H8=( n-xf )P / (n+xf) .
K = PH2 PC3H6/ PC3H8=xf2 P / [(n+xf) (n-xf)]=xf2 P / (n2-x2f).
On divise numérateur et dénominateur par n2.
K =t2 P / (1-t2) =t2 / (1-t2).
DrG°= -RT ln K ; ln K = -86,2 / (8,314 x298)= -0,0348.
K = 0,966.
0,966(1-t2)= t2 . 0,966 =1,966 t2 .
t ~0,70.
4.
On souhaite améliorer le rendement de la conversion du propane et
porter le taux d'avancement à 90 %. Quelle valeur devrait prendre la
constante d'équilibre ?
K=t2 / (1-t2) = 0,92 /(1-0,92) =4,26.
5. Quel(s) facteur(s) peut-on modifier pour, à partir de la situation présentée initialement, améliorer le taux de conversion ?
Diminuer la pression, augmenter la température, la réaction étant endothermique.
2. La surfusion de l'eau.
A -10°C et à pression atmosphérique, on observe de l'eau à l'état
liquide ( surfusion). Calculer la quantité de glace formée après une
transformation adiabatique ? On considère une mole d'eau.
Le passage de l'eau à l'état liquide à l'état solide s'effectue à la pression atmosphérique et à la température de 273,15 K.
Chemin fictif : m0=18 g à -10°C. 0,018 Ceau.
m0=18 g à 0°C.
(m0-mg) Ceau + mg Cglace à 0°C.
DH =m0(0-(-10)) Ceau +mg(-DH fusion )= 0 ( adiabatique).
mg / m0 = 10 Ceau / DH fusion.
Ceau =4,18 kJ kg-1 ; DH fusion =333 kJ kg-1.
mg / m0 =41,8 /333 =0,126.
mg =0,126 x18=2,26 g.
|
|
|
|