Teneur
en ion salicylate dans une crème,
bac général Asie
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| .. |
.
.
|
|
.
.
|
..
..
......
...
|
L'étiquette
d'un flacon indique " ion salicylate formulé à 1000 mg pour 100 g de
crème". Cela correspond à un pourcentage massique wréf =1,00 %.
L'ion salicylate sera noté HL-.
L'ion salicylate absorbe dans le domaine ultra-violet. Mais lorsqu'il réagit avec l'ion Fe3+, il forme une espèce coloré absorbant dans le visible.
Etude de la réaction entre l'ion Fe3+ et HL-.
Fe3+aq + HL-aq = FeL+aq + H+aq (1).
Seul FeL+aq est très coloré.
La constante de cet équilibre est K = 102,9 à 25°C.
On prépare une solution Sfer contenant des ions Fe3+ à la concentration Cfer = 10,0 mmol / L = [Fe3+]. C'est de plus une solution tampon de pH = 3,0.
On dispose d'une solution aqueuse "mère" S0 de salicylate de sodium de concentrtion C0 = 100 mmol / L. A partir de S0 on prépare une solution S1 de concentration C1 = 10,0 mmol / L.
1. Déterminer la masse m de salicylate de sodium LHNa solide qu'il a fallu peser pour préparer V0 =100,0 mL de la solution S0.
n = C0V0=0,100 x 0,100 = 1,00 10-2 mol.
M(LHNa)=160,1 g / mol.
m = 1,00 10-2 x160,1 = 1,60 g.
2. Identifier la verrerie à utiliser pour préparer V1 = 50,0 mL de la solution S1 à partir de S0.
Fiole jaugée de 50,0 mL.
Facteur de dilution F = 100 / 10 = 10.
Pipette jaugée de volume 50 / 10 = 5,0 mL.
Le milieu réactionnel est obtenu en mélangeant dans un becher :
Vfer = 10,0 mL de solution Sfer tamponnée.
V = 0,100 mL de solution S1.
3. Rappeler les propriétés d'une solution tampon et justifier que le pH du milieu ne varie pas.
Une solution tampon modère les variations de pH suite à l'ajout modéré d'une base ou d'un acide, suite à une dilution modérée.
V << Vfer, le pH du milieu ne varie pas.
4. Compléter le tableau d'avancement.
|
Avancement (mol)
|
Fe3+aq
|
+HL-aq
|
=FeL+aq
|
+H+aq
|
Initial
|
0
|
Cfer Vfer
|
C1V
|
0
|
n(H+)
constante
|
Equilibre
|
xéq
|
Cfer Vfer-xéq
|
C1V-xéq
|
xéq
|
5. Exprimer K à l'équilibre.
K = [FeL+aq ] [H+aq ] / ( [Fe3+aq ] [ HL-aq] )
[Fe3+aq ]= (Cfer Vfer-xéq) / (V+Vfer) ; [HL-aq ] =(C1V-xéq) /(V+Vfer) ; [FeL+aq ] = xéq / (V+Vfer).
K = xéq [H+aq ](V+Vfer) / ((Cfer Vfer-xéq)(C1V-xéq)).
l'application numérique conduit à : K = 102,9 =1,01 10-5 xéq / ((1,00 10-6-xéq)(1,0 10-4-xéq)).
Les deux solutions de cette équations sont : x1 = 9,999 10-7 mol et x2 = 9,999 10-5 mol.
6. Indiquer pourquoi il convient de ne retenir que x1 et conclure.
xéq ne peut pas être supérieur à 1,00 10-6, quantité de matière initiale de HL-.
1,00 10-6-xéq= 1,00 10-6-9,999 10-7~1,0 10-10.
Le réactif limitant est entièrement consommé : la réaction est totale.
|
...
|
....
|
Dosage spectrophotométrique des ions HL-.
Pour la réaction (1), on a : n(FeL+) produit = n(HL-) réagi.
L'espèce FeL+ est dosé par spectrophotométrie et par étalonnage.
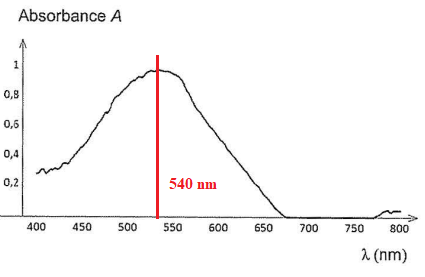
On donne le spectre d'absorption de FeL+.
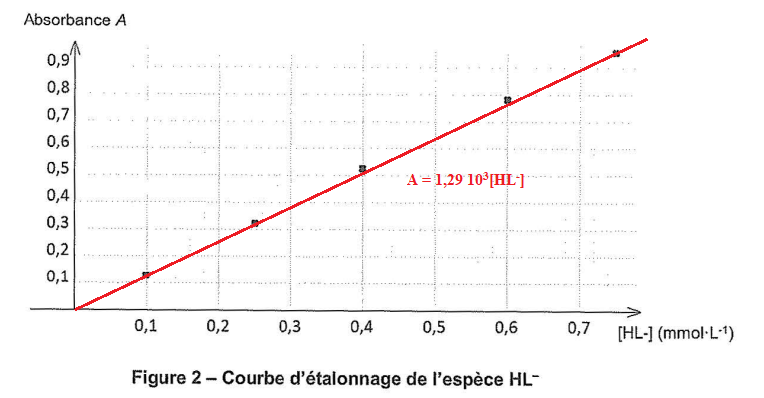
Pour tracer la courbe d'étalonnage on a préparé 5 solutions étalons en mélangeant :
Vfer = 10 mL de solution Sfer et V = 0,10 mL d'une solution de salicylate de sodium de concentration Ci connue.
On mesure l'absorbance d'une solution préparée en mélangeant Vcrème = 0,100mL de la crème et Vfer = 10 mL de la solution Sfer.
l'ansorbance mesurée à 540 nm est 0,83.
7. Indiquer la couleur de FeL+.
Le maximum d'absorption est à 540 nm ( couleur verte). La solution possède la teinte complémentaire du vert, soit le magenta.
8. Déterminer la quantité de matière en ion HL- présente dans la crème et en déduire le pourcentage massique mesuré wmes en ion salicylate.
[HL- ] =A / (1,29 103) =0,83 / (1,29 103) =6,434 10-4 mol / L.
Soit 6,434 10-4 x10,1 =6,498 10-3 mmol dans 0,100 mL de crème.
M(HL-) = 137,1 g /mol.
6,498 10-3 x 137,1 = 0,891 g = 891 mg.
Masse volumique de la crème : 860 g / L.
Masse de 0,1 mL de crème : 860 x1,0 10-4 =0,086 g = 86 mg.
Tenir compte de la dilution au dixième : 8,6 mg.
wme = 8,6 / 891 x100 = 0,97 %.
9. Comparer ce résultat à celui de l'étiquette. On admet que u(w) = 0,02 %.
(wréf -wmes) / u(w) = (1-0,97) / 0,02=1,5 < 2.
Les deux résultats sont en accord..
|
|