Les solutions aqueuses de peroxyde d’hydrogène H
2O
2
(ou eau oxygénée) sont très utilisées dans
différents domaines industriels comme agent de blanchiment ou comme désinfectant.
Le stockage de ces solutions aqueuses doit faire l’objet d’une grande vigilance pour éviter les
accidents dus à la surpression engendrée par la production de dioxygène gazeux.
En effet, le peroxyde d’hydrogène en solution aqueuse se décompose selon une transformation
modélisée par une réaction chimique dont l’équation est :
2 H
2O
2(aq) → 2 H
2O(ℓ) + O
2(g) (équation 1).
Cette transformation étant très lente, les solutions aqueuses de peroxyde d’hydrogène sont
relativement stables et peuvent être stockées dans des récipients inertes et rigoureusement
propres. Cependant, la décomposition du peroxyde d’hydrogène se trouve accélérée et les solutions
deviennent instables sous l’action de certains facteurs :
- des traces de métaux ou d’ions métalliques (comme les ions Cu
2+, Fe
3+
, …) ;
- le pH : les solutions aqueuses de peroxyde d’hydrogène sont moins stables en milieu basique
qu’en milieu acide (la stabilité maximale se situe à un pH compris entre 3,5 et 4,5) ;
- une augmentation de la température ;
- les radiations : les rayons UV activent la décomposition.
A. Conditions optimales de stockage
Q.1. Le stockage des solutions de peroxyde d’hydrogène s’effectue dans des conteneurs en
acier inoxydable. Justifier qu’il est impératif que ces conteneurs soient opaques à la lumière
et entreposés dans des endroits réfrigérés.
La lumière solaire contient des UV qui activent la décomposition.
La température étant un facteur cinétique, la décomposition est ralentie à basse température.
Q.2. Une solution aqueuse de peroxyde d’hydrogène pour laquelle la concentration en ions
oxonium est mesurée à 5,0×10
-5 mol∙L
-1
se situe-t-elle dans le domaine de stabilité
maximale ? Justifier par un calcul.
pH = - log(
5,0×10-5) =4,3, valeur appartenant à la zone de pH de stabilité maximale.
B. Étude de la vitesse de décomposition du peroxyde d’hydrogène.
Un laboratoire spécialisé dans les risques chimiques réalise une étude sur la vitesse de
décomposition de solutions aqueuses diluées de peroxyde d’hydrogène en présence d’ions fer (III)
Fe
3+
.
Pour suivre l’évolution temporelle de la concentration en peroxyde d’hydrogène, la quantité
de matière de H
2O
2 restante à différentes dates est déterminée à partir de titrages colorimétriques
successifs par les ions permanganate MnO
4
-
(aq) présents dans une solution de permanganate de
potassium. La réaction d’oxydoréduction support de titrage a pour équation :
2 MnO
4
-
(aq) + 6 H
+
(aq) + 5 H
2O
2
(aq) → 2 Mn
2+(aq) + 5 O
2
(g) + 8 H
2O(l) (équation 2).
L’étude est réalisée à partir d’une solution S de peroxyde d’hydrogène de concentration en soluté
apporté C
S.
Dans un premier temps, la concentration avant décomposition C
S est déterminée grâce à un titrage
par les ions permanganate selon le protocole expérimental suivant.
- Verser un volume de 10 mL de solution S dans un bécher de 100 mL.
- Ajouter un volume de 10 mL de solution d'acide sulfurique à 2,5 mol∙L
-1
.
- Titrer par une solution de permanganate de potassium de concentration C = 5,0 x 10
-2 mol∙L
-1
en ions permanganate. L’équivalence est marquée par un brusque changement de couleur
après avoir ajouté un volume V
E = 8,0 mL de solution titrante.
Q.3. Expliquer l’intérêt de l’ajout d’acide sulfurique à la solution S.
Les ions H
+ sont l'un des réactifs ; ila sont apportés par l'acide sulfurique.
Q.4. Légender le schéma du montage de titrage donné.
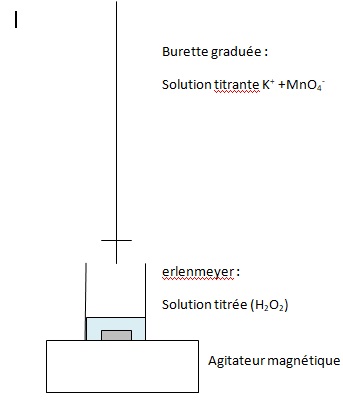 Q.5.
Q.5. En exploitant l’équation 2, déterminer la concentration C
S de la solution S.
A l'équivalence n(MnO
4-) = C V
E =5,0 10
-2 x8,0 =0,4 mmol.
n(H
2O
2 ) = 2,5
n(MnO4-) =2,5 x0,4 = 1,0 mmol dans 10 mL de solution S.
CS = 1,0 / 10 = 0,10 mol/ L.
Le peroxyde d’hydrogène présent dans la solution S se décompose selon la réaction d’équation 1
après ajout des ions Fe
3+. Le suivi de l’évolution temporelle de la concentration en H
2O
2 est réalisé
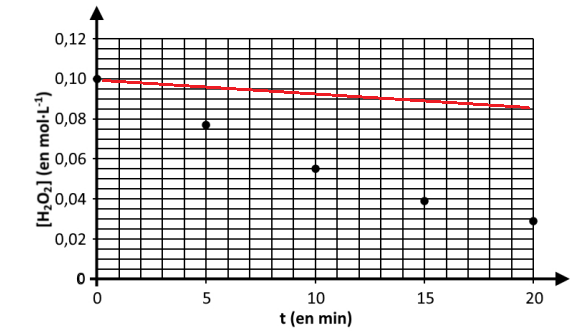
par titrages successifs aux dates 5, 10, 15 et 20 minutes.
Les résultats expérimentaux obtenus à la température de 20 °C sont rassemblés sur la figure suivante
.
Q.6. Indiquer le rôle des ions Fe
3+dans la décomposition du peroxyde d’hydrogène.
Catalyseur.
Q.7. Compléter la figure en traçant ce que serait l’évolution temporelle de
la concentration en quantité de matière de H
2O
2 en absence d’ions Fe
3+.