L’objectif de cet exercice est de
vérifier la concentration en quantité de matière d’acide
trichloroacétique du crayon utilisé pour traiter les verrues.
On souhaite préparer un volume V de valeur égale à 100,0 mL d’une solution S
0 d’acide trichloroacétique à 40,0% en masse.
Q1. Calculer la valeur de la masse m d’acide trichloroacétique à peser pour préparer cette solution S
0.
Masse volumique
r de la solution à 40,0% en masse d’acide trichloroacétique :
r = 1,50×10
3 g·L
–1 .
m asse de solution =
r V = 1,50 10
3 x 0,100=150 g.
Masse d'acide trichloroacétique : m= 150 x0,40 =60 g
Q2. Vérifier que la valeur de la concentration en quantité de matière c
0 de la solution S
0 d’acide trichloroacétique ainsi préparée, est égale à 3,67 mol·L
–1.
Masse molaire moléculaire de l’acide trichloroacétique : M = 163,5 g·mol–1.
n = m / M =60 / 163,5=0,367 mol.
c0=n / V = 0,367 /0,100=3,67 mol/ L.
On réalise une dilution au centième de la solution S
0. Cette solution diluée est notée S
1. Un volume V
1 = 20,0 mL de la solution S
1 est dosé par une solution aqueuse d’hydroxyde de sodium (Na
+(aq) + HO
-(aq)) de concentration c
2 = 5,00×10
–2 mol·L
–1.
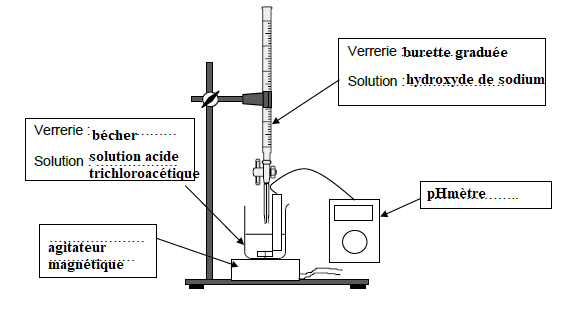
Q3. Annoter le schéma du dispositif utilisé pour le dosage pH-métrique réalisé.