Dans un élevage, l’eau de boisson
des poules doit être constamment traitée. Elle doit être
désinfectée tout au long de la chaîne de distribution, par exemple avec
du peroxyde d’hydrogène
H
2O
2, aussi appelé eau oxygénée.
Afin d’éviter le développement d’une flore intestinale pathogène et de
servir de vermifuge, le pH de
l’eau doit être constamment maintenu entre 5,5 et 6,5.
PARTIE A :
Le traitement de l’eau de boisson d’un élevage industriel de poules
L’oxydosane est un décontaminant et acidifiant des eaux de boisson pour
animaux. Il est notamment
utilisé dans les élevages de poules pondeuses.
C’est une solution composée notamment de peroxyde d’hydrogène. La
concentration en masse en
peroxyde d’hydrogène dans celle-ci est de 248 g ⋅ L
−1
.
Mode d’emploi (d’après le fabricant GEOSANE) :
Norme 1 : Pour la désinfection et l’acidification (présence de poules
dans l’élevage)
- Incorporer OXYDOSANE à raison de 100 mL à 200 mL pour un total de
1000 L d’eau.
-Dose à adapter en fonction du pH souhaité et de la désinfection
nécessaire.
Norme 2 : Durant le vide sanitaire (absence de poules dans
l’élevage)
- Incorporer OXYDOSANE à raison de 2,00 L pour un total de 100 L
d’eau.
- Temps de contact : au minimum 1 h.
- Faire suivre d’un long rinçage.
A. Décontamination de
l’eau en fin de chaine des abreuvoirs
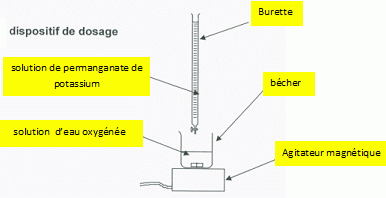
Afin de vérifier que l’eau de boisson de l’élevage est toujours
désinfectée en fin de chaine, l’éleveur
prélève V
1 = 20,00 ± 0,05 mL de cette eau et décide de
déterminer sa concentration c
1 en quantité
de matière de peroxyde d’oxygène H
2O
2 .
Pour cela, il procède au titrage du peroxyde d’oxygène présent dans le
volume V
1 prélevé, par une
solution de permanganate de potassium (K
+(aq), MnO
4
− (aq)) acidifiée de concentration en quantité
de matière d’ions permanganate égale à [MnO
4
−]
i = c
0 = (1,00 ± 0,04) ×
10
−3 mol ⋅ L
−1
.
L’équation de la réaction support du titrage est la suivante :
2 MnO
4
− (aq) + 6 H
+(aq) + 5 H
2O
2 (aq) -->
2 Mn
2+(aq) + 8 H
2O (l) + 5 O
2
(g)
Lors de ce titrage colorimétrique, le volume obtenu à l’équivalence est
de V
éq = (6,60 ± 0,05) mL.
A.1 Faire la liste
du matériel nécessaire pour réaliser le titrage.
 A.2
A.2 Écrire les demi-équations électroniques mises en jeu lors du
titrage permettant de retrouver
l’équation de la réaction d’oxydo-réduction support du titrage.
MnO4- + 8H+ + 5e-
= Mn2+ + 4H2O (1)
O2 +
2H+
+ 2e- =H2O2 (2)
A.3 Définir l’équivalence du titrage et indiquer comment la repérer
expérimentalement.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
Avant l'équivalence, l'ion permanganate est en défaut, la solution est incolore.
Après l'équivalence, l'ion permanganate est en excès, la solution est violette.
A.4 Déterminer la valeur de la concentration c
1 et de son incertitude type associée u(c
1).
A l'équivalence : n(MnO
4-) =c
0 V
éq =1,00 10
-3 x6,60=6,60 10
-3 mmol.
n(H
2O
2)=2,5
n(MnO4-) =0,0165 mmol dans 20,0 mL.
c1 =0,0165 / 20 =8,25 10-4 mol / L.
u(c1) = c1[(u(Véq) / Véq)2+(u(V1) / V1)2+(u(c0) / c0)2]½=8,25 10-4[(0,05 / 6,6)2+(0,05 / 20)2+(0,04)2]½~8 10-5 mol / L.
c1 = (83 ±8) 10-5 mol / L.
A.5 Indiquer quelle norme, 1 ou 2, l’éleveur a suivi.
Norme 1 : 0,1 x248 / M(H
2O
2)=24,8 /34= 0,73 mol dans 1000 L ( 7,3 10
-4 mol / L)
0,2 x248 / M(H2O2)=49,6 /34= 1,46 mol dans 1000 L ( 1,4 103 mol / L)
Le fabricant préconise de placer le bidon d’OXYDOSANE, une fois ouvert, dans un endroit sombre
et frais. Il peut ainsi être conservé pendant un mois. Passé ce délai, la désinfection n’est plus
garantie.
A.6 Justifier le mode de conservation.
Les rayons UV et une température modérée favorisent la décomposition de l'eau oxygénée.