Partie A – Différentes voies de synthèse de l’acide benzoïque.
1. Synthèse industrielle de l’acide benzoïque.
Dans l’industrie, l’acide benzoïque peut être préparé à chaud (T = 150 °C) et sous
pression (P = 2,5 bar) par oxydation du toluène de formule C
6H
5–CH
3 avec le
dioxygène en présence d’un catalyseur : le pentoxyde de vanadium V
2O
5.
On donne les couples oxydant / réducteur suivants :
C6H5–COOH /
C6H5–CH3
; O
2 / H
2O.
Q1. Définir une réaction d’oxydation.
Lors d'une réaction d'oxydation, un réducteur libère un ou plusieurs électrons.
Q2. Écrire les équations de demi-réaction électronique pour chaque couple redox.
Q3. Vérifier que l’équation de réaction modélisant la transformation chimique du
toluène en acide benzoïque lors de la synthèse industrielle peut s’écrire :
2C6H5–CH3 +3O2 --> 2 H2O+2C6H5–COOH.
2 fois {C6H5–CH3 +2H2O--> C6H5–COOH+ 6H+ + 6e- }
3 fois {O2 +4H++4e- --> 2 H2O }
Ajouter : 2C6H5–CH3 +4H2O +3O2 +12H++12e- --> 6 H2O+2C6H5–COOH+ 12H+ + 12e-
Simpliifier : 2C6H5–CH3 +3O2 --> 2 H2O+2C6H5–COOH.
Q4. Expliquer le rôle d’un catalyseur.
Un catalyseur accélère une réaction thermodynamiquement possible. Il
intervient dans la première étape et se trouve régénéré dans la
dernière étape : il n'apparaît pas dans le bilan.
2. Synthèse de l’acide benzoïque au laboratoire
Au laboratoire, l’acide benzoïque est obtenu à partir du benzaldéhyde en réalisant une
réaction de Cannizzaro suivie d’une acidification du
milieu réactionnel.
2 C6H5-CHO + HO– --> C6H5-CO2
– + C6H5-CH2-OH .
a) Introduire dans un ballon équipé d’un barreau aimanté 14,0 mL de benzaldéhyde,
14,0 g de pastilles d’hydroxyde de potassium et 20 mL d’eau.
b) Réaliser un montage à reflux et chauffer à ébullition douce pendant 30 minutes.
c) Arrêter le chauffage et ajouter 20 mL d’eau au mélange réactionnel jusqu’à
obtention d’une solution homogène.
d) Refroidir puis verser la solution dans une ampoule à décanter.
e) Rincer le ballon avec 30 mL d’éther diéthylique et ajouter cette phase éthérée à
la solution dans l’ampoule à décanter.
f) Laisser décanter et recueillir la phase aqueuse et la phase éthérée dans
deux erlenmeyers différents.
g) Placer l’erlenmeyer contenant la phase aqueuse dans un bain de glace et verser
avec précaution de l’acide chlorhydrique de concentration
C = 2,0 mol / L jusqu’à précipitation complète de l’acide benzoïque.
h) Filtrer et rincer les cristaux à l’eau froide puis les sécher.
Analyse du protocole expérimental.
Q5. Indiquer les deux produits qui se forment lors de la transformation chimique qui
se déroule durant l’étape (b).
Ion benzoate et alcool benzylique.
Q6. Expliquer, en justifiant la réponse, le rôle
de l’éther diéthylique au cours de la synthèse.
Seuls les produits de la réaction sont très solubles dans l'éther éthylique.
Q7. Compléter le
schéma de l’ampoule à décanter en indiquant la composition des phases 1 et 2.
Justifier la réponse.
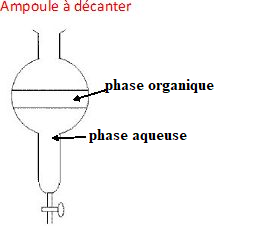
La phase aqueuse, la plus dense occupe la partie inférieure ; l'éther, phase la moins dense, occupe la partie supérieure.
Couples acide / base : C
6H
5–COOH(aq) / C
6H
5–COO
–
(aq) ; H
3O
+
(aq) / H
2O(ℓ)
Q8. En utilisant les couples acide / base ci-dessus, écrire l’équation de la réaction
permettant d’obtenir l’acide benzoïque, lors de l’étape d’acidification (étape g).
C6H5–COO–
(aq) +H3O+
(aq) --> C6H5–COOH(aq) +H2O(ℓ).
Q9. Justifier l’intérêt de placer l’erlenmeyer dans un bain de glace.
L'acide benzoïque est trèss peu soluble dans l'eau à 0°C. Il précipite.
Identification du réactif limitant et détermination du rendement de la synthèse
Q10. Déterminer la valeur de la quantité de matière des réactifs introduits dans le
ballon.
14,0 mL de benzaldéhyde, masse volumique 1,04 , M =106 g / mol.
14,0 x1,04 / 106 =0,137 mol.
14,0 g de pastilles d’hydroxyde de potassium, m = 56,1 g/mol.
14,0 / 56,1 =0,250 mol.
Q11. Montrer que le réactif limitant est le benzaldéhyde.
0,25 mol d'hydroxyde de potassium pevent réagir avec 0,50 mol de benzaldéhyde. Ce dernier est en défaut.
Après la synthèse en laboratoire, on obtient une masse m
1 = 6,45 g de cristaux d’acide
benzoïque.
Q12. Sachant que la quantité de matière maximale possible d’acide benzoïque vaut
6,85 × 10
–2 mol, calculer le rendement de la synthèse au laboratoire.
m
1 / M(acide benzoïque )= 6,45 / 122 =5,29 10
-2 mol.
Rendement =
5,29 10-2 / (6,85 × 10–2) =0,77 (77 %).
Mécanisme réactionnel.
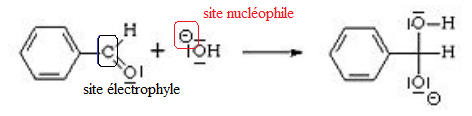
Q13. Entourer de
deux façons différentes qui sont à préciser sur le schéma, le site électrophile du
benzaldéhyde et le site nucléophile de l’ion hydroxyde.
 Partie B – Fonctionnement du bain thermostaté utilisé lors de la
synthèse en laboratoire
Partie B – Fonctionnement du bain thermostaté utilisé lors de la
synthèse en laboratoire.
Le chauffage du ballon lors de la synthèse de l’acide
benzoïque est effectué par un bain d’huile thermostaté.
On considère un bain contenant un volume V
0 = 5,0 L
d’huile de silicone chauffé à la température
qhuile = 150 °C.
La surface libre de ce bain est : S
0 = 400 cm
2
.
Quelques caractéristiques de l’huile de silicone
- capacité thermique massique : c
hs = 1800 Jꞏkg
–1ꞏK
–1 ;
- masse volumique : µ = 950 kgꞏm
–3 = 0,950 kgꞏL
–1 ;
- température de fusion :
qf = 50 °C ;
- température d’ébullition :
qéb = 315 °C.
L’huile se refroidit par rayonnement et par convection à l’interface huile / air du bain.
Dans ces conditions, on peut montrer que la puissance perdue par le bain vaut 125 W,
lorsque la température de l’air ambiant vaut
qair = 20 °C et que la température de l’huile
vaut environ
qhuile = 150 °C.
Le bain d’huile est à la température 150 °C. Le chauffage du bain d’huile s’arrête alors.
Q14. Montrer en effectuant un bilan d’énergie appliqué au système {huile de silicone
contenue dans le bain thermostaté} que le temps au bout duquel sa température
baisse de
Dq = 1 °C vaut :
Dt = 68 s.
Energie perdue par l'huile : 125
Dt = V
0 µ
chsDq .
Dt = V0 µchsDq / 125 =5,0 x0,950 x1800 /125~ 689 s.
Données :
- le maintien du chauffage est assuré par une résistance électrique dont la puissance
est telle qu’elle permet d’augmenter la température de l’huile de 1 °C en 15 s.
- le bain possède une régulation de température « Tout Ou Rien » (TOR) à deux
niveaux de consigne (deux valeurs de seuil) : la valeur programmée et cette même
valeur moins 1 °C.
Q15. À l’aide des données ci-dessus, répondre aux trois questions suivantes :
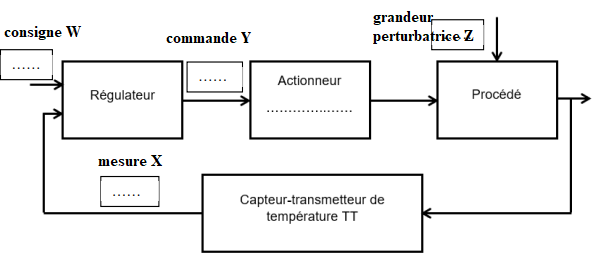
- déterminer la grandeur réglée du dispositif de chauffage au bain d’huile
et ses deux valeurs de seuil ;
Température du bain 150°C ; valeurs de seuil : 149 et 151°C
- donner la grandeur réglante ;
température du bain.
- déterminer la grandeur perturbatrice.
refroidissement de l'huile.
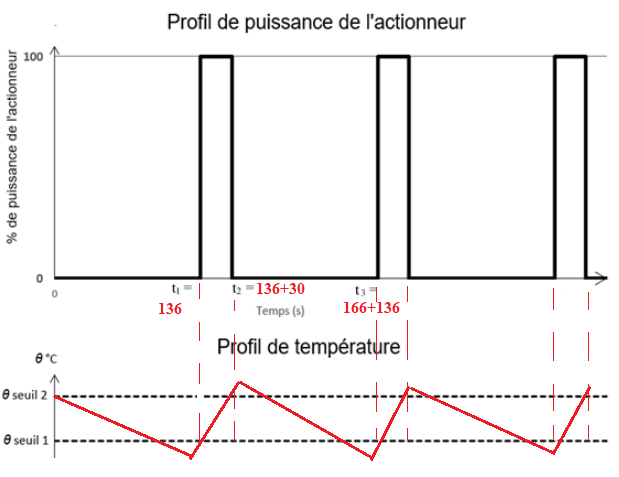
Q16. Compléter le schéma de la boucle de régulation.
 Q17.
Q17. Sur le graphe d’activité de l’actionneur :
- dessiner l’évolution temporelle de la température mesurée sachant que la
température initiale est
q seuil 2 ;
- indiquer les valeurs de t
1, t
2 et t
3, en utilisant les résultats et les données
des questions Q14 et Q15.