Exercice 1 : Acide lactique et acidose (10 points)
Les maladies mitochondriales peuvent provoquer une acidose
lactique qui est une surproduction d’acide lactique pouvant entraîner
une acidification du sang et des tissus générant des troubles
cardiaques.
La formule semi-développée de l’acide lactique est donnée.
1. Écrire la formule brute de l’acide lactique et calculer la masse molaire M
a de l’acide lactique.
Données :
Masses molaires atomiques M(C) = 12 g·mol
-1 ; M(H) = 1,0 g·mol
-1 ; M(O) = 16 g·mol
-1.
M(C
3H
6O
3) =3 x12 +6 +3x16=90 g/mol
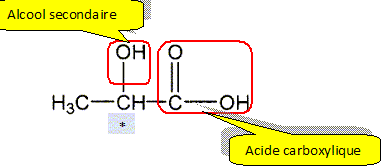
2. Recopier la formule semi-développée de l’acide lactique sur
la copie. Entourer et nommer les groupes fonctionnels présents dans
cette molécule.
3. Indiquer en
justifiant si les deux représentations ci-dessous correspondent à la
même molécule. Préciser le nom donné à un couple de molécules possédant
cette propriété.
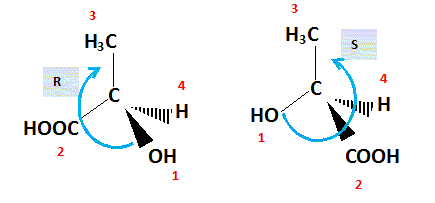
Couple d'énantiomères. ( présence d'un atome de carbone asymétrique).
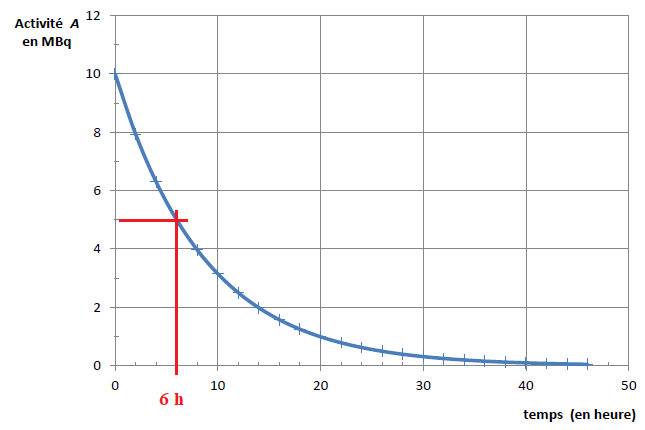
Les valeurs normales de la concentration en masse de l’acide lactique dans le sang sont comprises entre 50 et 180 mg·L-1. L’analyse de sang d’un patient atteint d’une maladie mitochondriale révèle une concentration d’acide lactique égale à
C = 2,8 mmol·L-1.
4. Déterminer si ce patient souffre d’une surproduction d’acide lactique.
2,8 x90=252 mg / L, valeur supérieure à 180 mg / L.
Ce patient souffre d’une surproduction d’acide lactique.
5.
Dans le corps humain, la production d’acide lactique est issue d’une
réaction d’oxydoréduction faisant intervenir l’acide pyruvique selon la
demi-équation électronique suivante :
Acide pyruvique + 2H+ + 2e− = Acide lactique
Préciser si, dans cette demi-équation électronique, l’acide lactique est un oxydant ou un réducteur. Justifier.
L'acide pyruvique gagne deux électrons, c'est un oxydant qui se réduit.
L'acide pyruvique est l'oxydant du couple acide pyruvique / acide lactique.
6. L’acide lactique est aussi un acide selon Brönsted. Définir cette propriété.
L'acide lactique est susceptible de céder un proton H+. Il joue le rôle d'acide.
7. Écrire l’équation de la réaction acido-basique qui se produit entre l’acide lactique noté HA et l’eau.
AH aq + H2O(l) = H3O+aq + A-aq.