La
sertraline, principe actif d'un antidépresseur,
BTS Métiers de la chimie 2021.
U41 - Etude de protocoles de synthèse et
d'analyse.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Partie 1. Étude de synthèses de la (+)-sertraline.
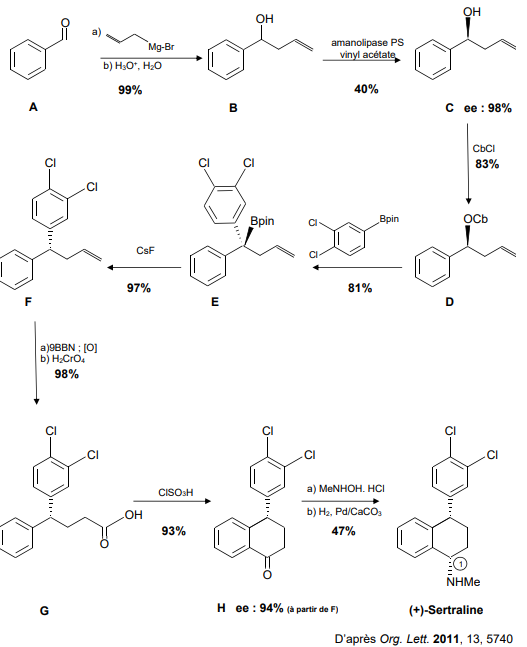 1.
1. Nommer les groupes caractéristiques de la molécule de (+)-sertraline.
 2.
2. Calculer le rendement de la synthèse de la (+)-sertraline à partir du composé A.
0,99 x 0,40 x0,98 x0,83 x0,81 x0,97 x0,98 x0,93 x0,47~0,11 (11%).
3. A propos de la dernière étape, les auteurs de la publication écrivent : « the tetralone H
was converted to (+)-sertraline by reductive amination in 47% yield with a cis/trans ratio of
96,5 : 3,5. ». Expliquer les termes « cis » et « trans » ainsi que le signe « + » qui apparaît
dans le nom de l’espèce : (+)-sertraline.
La tétralone H a été convertie en (+)-sertraline par amination
réductrice avec un rendement de 47 % avec un rapport cis/trans de 96,5
: 3,5.
On considère le plan moyen du cycle : deux substituants sont cis s'ils
sont placés du même côté de ce plan et trans s'ils se trouvent de part
et d'autre de ce plan.
Une molécule dextrogyre fait tourner le plan de polarisation d'une lumière polarisée vers la droite ; elle est notée (+) ou (d).
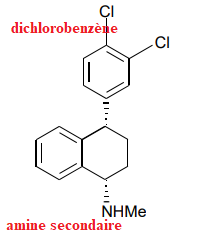
4. Donner la représentation de Cram de l’énantiomère de la (+)-sertraline et celle d’un de
ses diastéréoisomères.
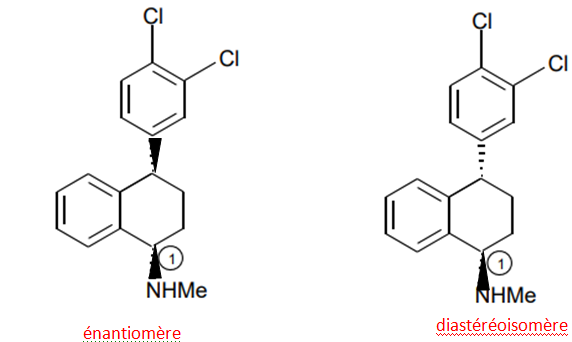 5.
5. Déterminer, en justifiant la réponse, le descripteur stéréochimique (ou « configuration
absolue ») du carbone numéroté 1 de la (+)-sertraline.
 6.
6. Définir ce qu’est une réaction stéréosélective et identifier, en justifiant, deux étapes
stéréosélectives dans le schéma de synthèse de la (+)-sertraline.
Une réaction est stéréosélective si elle donne une prépondérance à un produit de stéréochimie déterminée plutôt qu'à un autre.
Passage de B à C et dernière étape.
7. Déterminer la fraction molaire de H dans le mélange d’énantiomères obtenu à l’issue de
la septième étape et proposer une technique expérimentale permettant à un technicien de
vérifier cette composition au laboratoire.
ee = | %[R] -% [S] |=94.
%[R] +%[S] = 100.
Si %[R] -%[S] >0 : 2 * %[R]=194 ; %[R] =97.
Si %[R] -%[S] < 0 : 2 * %[S]=194 ; %[S] =97.
Mesure du pouvoir rotatoire ( polarimétrie).
A. Mise en œuvre de la première étape de la synthèse.
Le mécanisme simplifié de l’étape 1.a de cette synthèse est donné ci-dessous :
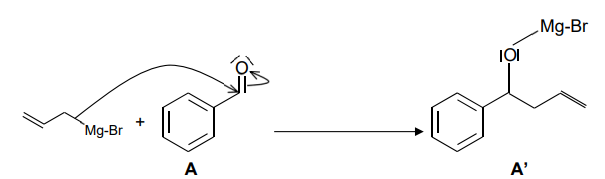 8.
8. En s’appuyant sur le mécanisme, identifier le type de réaction mise en jeu lors de
l’étape 1.a.
Addition nucléophile sur la liaison C=O.
9. Citer un intérêt à utiliser l’identifiant Chemical Abstract Service (CAS Number) d’un
composé pour un technicien de laboratoire dans sa pratique quotidienne.
Ces numéros donnent des informations précises et fiables sur les produits chimiques.
Ils permettent d'assurer la sécurité en minimisant les risques ( éviter les erreurs de manipulation, de stockage).
10. Pour chaque conditionnement de réactif, déterminer le coût en réactifs de l’étape 1.a
pour former 5,0 g d’alcool B sachant que l’étape 1.b (hydrolyse en milieu acide) a un
rendement de 100%. Argumenter le choix de conditionnement à retenir au laboratoire.
B (C 10H 12 O) : masse molaire M =148 g / mol ; n = 5,0 /148 =0,0338 mol.
A(C 7H 6O) ; M = 106 g / mol ; n = 0,0338 mol ; masse =0,0338 x106 ~3,6 g ( rendement 99 % pris en compte).
Volume : ~3,6 mL.
Alkylmagnésium bromide 1 mol / L ; n = 0,0338 mol.
|
100 mL
|
800 mL
|
| Alkylmagnésium bromide 100 mL |
74 €
|
381 €
|
Benzaldéhyde
|
100 mL
|
1 kg
|
|
58,3 €
|
38,4 €
|
100 mL A et 1 kg benzaldehyde : 112,4 €
|
100 mL A et 100 mL benzaldehyde :132,3 €
|
| 800 mL A et 100 mL benzaldehyde :439,3 € |
| 800 mL A et 1 kg benzaldehyde :419,4 € |
Effectuée au laboratoire par plusieurs techniciens, la synthèse de l’alcool allylique B
conduit à des rendements autour de 30 %, nettement inférieurs à ceux avancés dans la
publication. L’hypothèse d’une mauvaise qualité du benzaldéhyde liée à une oxydation en
acide benzoïque au contact de l’air est émise.
11. Écrire l’équation de la réaction modélisant l’oxydation du benzaldéhyde par le
dioxygène.
C6H5-CHO + ½O2 --> C6H5-COOH.
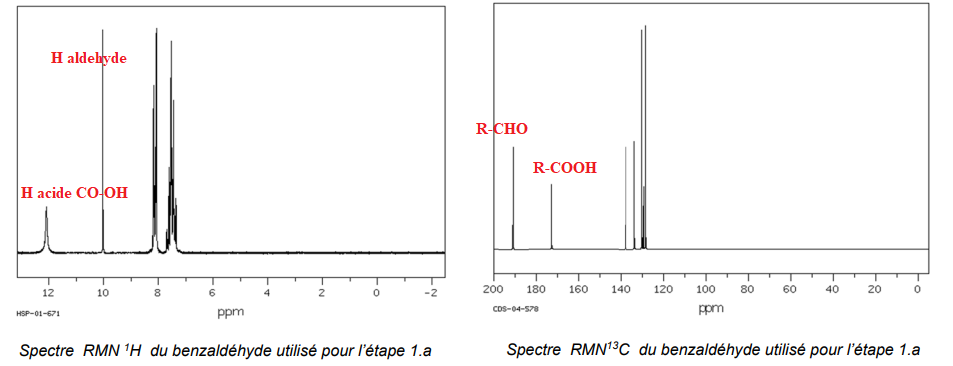
Les spectres RMN 1H et 13C du benzaldéhyde utilisé lors de la synthèse sont réalisés et
reproduits ci-après.
12. Montrer, en analysant les signaux des deux spectres, qu’ils confirment l’hypothèse
formulée par les techniciens.
Pour déterminer la quantité d’acide benzoïque présent, un dosage est effectué en mettant en
œuvre le protocole suivant.
La masse prélevée est m = 0,293 g et la concentration de la solution titrante d’hydroxyde de
sodium C NaOH = 0,0998 mol∙L -1.
Le suivi de l’évolution du pH au cours du titrage et sa courbe dérivée sont tracés par le
technicien et reproduits ci-après.
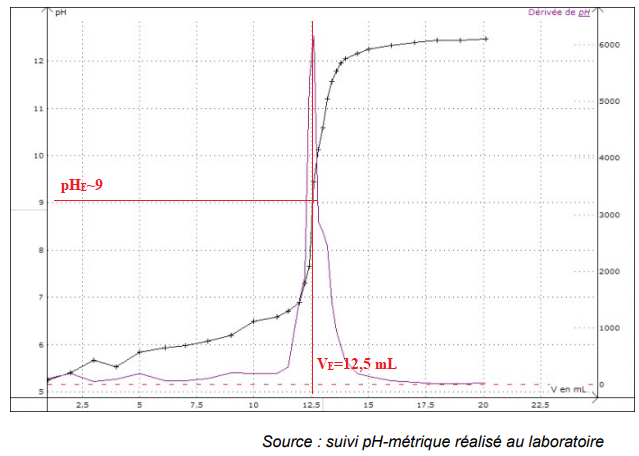 13.
13. Choisir un indicateur coloré à utiliser pour réaliser un dosage rapide préalable.
La zone de virage de l'indicateur doit contenir le pH du point équivalent, pH ~9 dans ce cas.
Phénolphtaléine ; bleu de thymol.
14. Déterminer la fraction massique d’acide benzoïque dans le benzaldéhyde que révèle le
dosage et commenter le résultat au regard des rendements obtenus par les techniciens.
n(RCOOH) = V E C NaOH = 12,5 x 0,0998~1,25 mmol.
M(ac benzoïque) = 122 g / mol ; m =1,25 x122 =152,5 mg ~0,152 g.
Soit 0,152 / 0,293 x100 =52 %.
La moitié du benzaldehyde est oxydé en acide benzoïque, ce qui explique un rendement de l'ordre de 30 %.
|
...
|
....
|
B. Une alternative à l’étape 1 plus respectueuse de l’environnement.
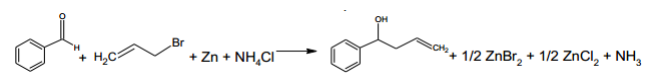
À t = 0 min, tous les réactifs sont mélangés.
L’avancement de la réaction est suivi par
chromatographie sur couche mince (CCM), en prélevant
toutes les minutes 1 millilitre environ du milieu
réactionnel et en réalisant une extraction de la phase
organique avec de l’éther.
Les dépôts de la phase organique à différentes dates
de prélèvement, de t = 0 à 7 minutes, et une révélation
sous UV ont permis d’obtenir les chromatogrammes suivants.
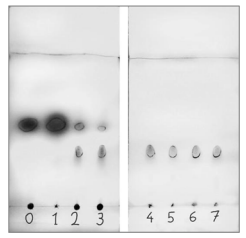
.
15. À partir des chromatogrammes obtenus, estimer la durée nécessaire pour la formation de
la totalité du composé B.
Au bout de 4 minutes,seule les taches correspondant au produit B sont visibles.
16. Proposer deux arguments justifiant l’intérêt d’un procédé « one pot » pour s’inscrire dans
une démarche de chimie verte.
Conception de méthodes de synthèse moins dangereuses : milieu aqueux en utilisant le zinc à la place du magnésien.
Solvant moins polluant.
C. Choix des conditions de réalisation de l’étape 4.
17. Identifier les paramètres dont l’influence a été testée pendant l’étude et déterminer les
conditions optimales de mise en œuvre de l’étape 4 de la synthèse.
Solvant, température, durée.
12-crown-4, 0,1 equiv H2O, 1 h, -78°C.
D. Étude de l’étape 6
Le mécanisme simplifié de l’étape 6.a est donné ci-dessous :
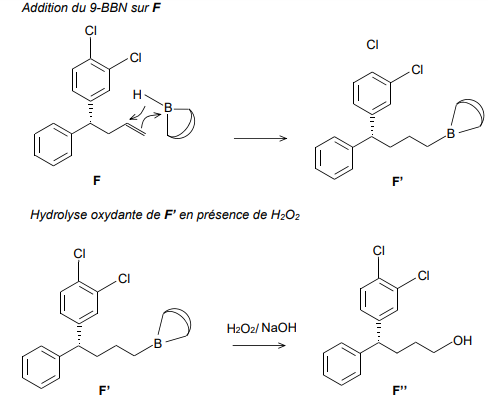
18. En s’appuyant sur le mécanisme, identifier la nature de la sélectivité de cette étape.
Addition anti-markovnikov.
L’étape 6b de la synthèse, présentée ci-dessous, est une oxydation par le réactif de
Jones, mettant en jeu de l’acide chromique :

Une variante plus respectueuse de l’environnement peut être envisagée, en utilisant une
solution à 10% de peroxyde d’hydrogène, en présence de catalyseur organométallique.
19. Expliquer pourquoi la substitution du réactif de Jones par le peroxyde d’hydrogène
participe d’une synthèse plus respectueuse de l’environnement.
L'acide chromique est toxique, dangereux pour l'environnement et c'est une matière comburante.
Le peroxyde d’hydrogène est fourni sous la forme d'eau oxygénée à 110 volumes.
La solution à 10 % de peroxyde d’hydrogène est préparée à partir d’une solution d’eau
oxygénée à 110 volumes titrée suivant le protocole ci-dessous.
Dans un erlenmeyer, introduire :
- une prise d’essai E = 5,0 mL de solution d’eau oxygénée à 110 volumes diluée au
centième ;
- 50 mL de solution d’acide sulfurique diluée au dixième ;
-
100 mL d'eau déminéralisée.
Remplir la burette de la solution de permanganate de potassium à environ 0,02 mol∙L-1 et
ajouter des volumes successifs de cette solution à la prise d’essai.
Le titrage est mis en œuvre avec une solution titrante de permanganate de potassium de
concentration C = 0,0203 mol∙L-1. Le volume obtenu à l’équivalence est de 9,85 mL.
20. Vérifier si cette analyse confirme le titre en volumes de la solution d’eau oxygénée.
2 MnO4- + 6H+ +5H2O2 --> 2 Mn2++ 5O2 +8H2O.
n(permanganate) = 0,0203 x 9,85 ~0,200mmol.
n(eau oxygénée) = 2,5 x0,20 = 0,50 mmol dans 5,0 mL de prise d'essai.
Soit 0,50 / 5 = 0,10 mol / L.
Tenir compte de la dilution : 0,10 x 100 =10 mol / L.
H2O2 --> H2O + ½ O2.
à une mole d'eau oxygénée correspond ½ mol de dioxygène soit 11,2 L.
à 10 mol/ L correspond : 10*11,2 = 112 L O2 soit 112 volumes.
Le tableau ci-dessous donne la quantité de solvants utilisés pour fabriquer 1000 kg de
(+)-sertraline selon la première voie de synthèse et selon la voie la plus récente.
Première voie : éthanol : 34 000 L ; acétate d'éthyle 28 400 L, THF 19000 L ; toluène 8000 L ; hexane 12000 L.
Nouvelle voie de synthèse : éthanol 15 000 L ; acétate d'éthyle 9000 L.
21. Identifier, en justifiant, deux principes de la chimie verte qui incitent à privilégier la
nouvelle voie de synthèse.
Solvants et auxiliaires moins polluants.
Economie d'atomes.
Teneur en sertraline dans un comprimé de Zoloft.
La (+)-sertraline est le principe actif d’un médicament commercialisé sous l’appellation
Zoloft.. Un comprimé contient 50 mg de (+)-sertraline.
22. Donner la signification du sigle CLHP (ou HPLC en anglais).
Chromatographie liquide haute performance.
23. Schématiser et légender une chaîne d’analyse CLHP.
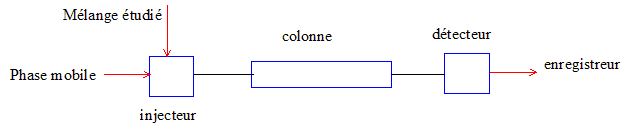
24. Identifier, dans le protocole expérimental, les phases stationnaire et mobile en
précisant leur polarité respective.
Phase mobile polaire : acétonitrile, méthanol, acétate d'ammonium.
Phase fixe apolaire ( colonne de phase inverse).
25. Indiquer la démarche à mettre en œuvre pour déterminer la longueur d’onde à
laquelle le dosage de la (+)-sertraline doit être mené.
La longueur d'onde du spectrophotomètre doit être celle qui permet la plus grande absorption.
26. Proposer un protocole de préparation de 10 mL de la solution de la gamme de
concentration 100 μg∙mL-1 à partir de la solution mère.
Environ 100 mg de (+)-sertraline pure sont pesés précisément et transférés dans une fiole
de 100 mL.
Cmère = 0,100 / 0,100 =1,0 g / L ou 1,0 mg / mL ou 1000 μg∙mL-1 .
Facteur de dilution : 1000/ 100 =10.
Prélever 1,0 mL de solution mère ; verser dans une fiole jaugée de 10 mL contenant 1 /3 d'eau distillée.
Agiter et compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
27. Déterminer la limite de détection et la limite de quantification de cette méthode.
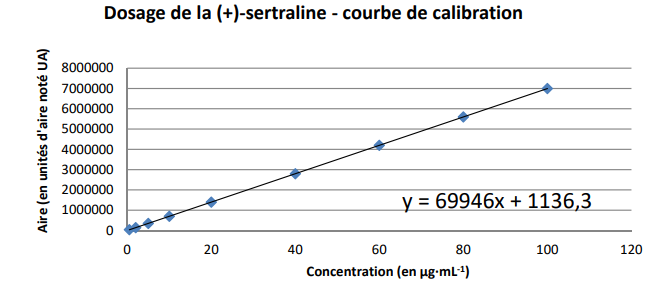
LD = 3 Sblanc /a= 3 x 786,6 / 69946 =0,0337 µg / mL.
LQ = 10 Sb /a = 10 x 786,6 / 69946 =0,1127 µg / mL.
28. Indiquer, en justifiant, si la méthode permet de mesurer un taux de (+)-sertraline
proche du seuil de toxicité dans le sang ( 290 ng / mL).
290 ng / mL = 0,29 µg / mL .
Cette valeur est supérieure à la LQ. Lla méthode permet de mesurer un taux de (+)-sertraline
proche du seuil de toxicité dans le sang.
Dosage d’un comprimé.
Peser et broyer 20 comprimés. Peser précisément l’équivalent de 100 mg de la poudre
obtenue et la transférer dans une fiole jaugée de 50 mL. Passer la solution aux
ultrasons pour assurer la complète dissolution du médicament avant de compléter la
fiole avec la phase mobile.
Filtrer cette solution sur une membrane de porosité 0,45 μm. Prélever 5 mL du filtrat
dans une fiole de 10 mL complétée avec la phase mobile.
20 μL de solution sont injectés dans la colonne. L’injection est répétée 2 fois.
Les pesées et résultats suivants sont obtenus.
Masse des 20 comprimés : 20,750 g ;
Masse de poudre pesée : 100,00 mg
Essai 1 Aire obtenue : 3 428 485
; Essai 2 Aire obtenue : 3 459 256
La relation permettant de calculer la masse m’ de (+)-sertraline, exprimée en mg, dans
les 100,00 mg de poudre pesés, à partir de la concentration C, en µg∙mL-1 de la solution
injectée est fournie par la procédure : m’ = 0,10×C.
29. Retrouver, par le calcul, la relation fournie par la procédure.
1 µg / mL = 0,001 mg / mL.
masse de (+)-sertraline dans 20 µL injectés :0,001 x20 C = 0,02 C µg ;
masse de (+)-sertraline dans 10 mL= 10 000 µL ( ou dans 5 mL de filtrat) : 0,02 x 10000 /20 C =10 C µg =0,01 C mg.
0,1 C mg dans 50 mL de filtrat soit dans 100 mg de poudre.
m' =0,1 C.
30. À partir des résultats obtenus pour chaque essai, déterminer la masse m de (+)-sertraline
dans un comprimé de Zoloft et l’exprimer avec une incertitude élargie relative de 1 % en
utilisant la procédure ISO 5725-6.
Pour le dosage effectué, sr = 0,26 mg, en tenant compte d’un facteur d’élargissement k = 2.
C1 =(3 428 485-1136,3) / 69946 =49,0 µg / mL. m'1 = 4,90 mg dans 0,100 g de poudre.
m1=4,90 x 20,75 / (20 x0,1)=50,84 mg.
C2 =(3 459 256-1136,3) / 69946 =49,4 µg / mL. m'2 = 4,94 mg 0,100 g de poudre.
m2=4,94 x 20,75 / (20 x 0,100)=51,3 mg.
(m2-m1) =0,46 mg.
2,8 sr = 2,8 x0,26 ~0,73
m2-m1< 2,8 sr donc m =(m1+m2) / 2 =51,07 mg.
31. Le laboratoire contrôle qualité impose une teneur en (+)-sertraline pour le comprimé
égale à 50,0 ± 0,5 mg. Conclure quant à la conformité des comprimés analysés.
51,07 n'appartient pas à [49,5 ; 50,5]. Les comprimés ne sont pas conformes.
Procédé de traitement des eaux contaminées par la (+)-sertraline.
La séparation par distillation membranaire est une nouvelle technologie.
Le principe est le suivant :
un gradient de pression de vapeur est créé au niveau de l’alimentation du dispositif de
séparation par chauffage de l'eau contaminée, entrainant son évaporation ;
la membrane hydrophobe limite le passage des contaminants ;
la vapeur d'eau qui a traversé la membrane, appelée « perméat », est condensée par
circulation d’eau de refroidissement et recueillie à l’état liquide. Débarrassé des
contaminants, le perméat pourrait être rejeté dans l’environnement.
32. Reproduire le schéma de principe en indiquant les débits volumiques et les
concentrations en masse de (+)-sertraline à l’entrée et aux sorties de la cellule membranaire.
33. En déduire le débit volumique de perméat.
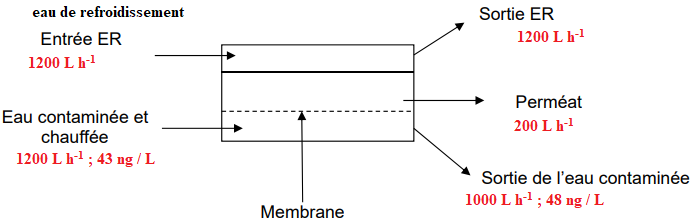
34. Calculer le débit massique en (+)-sertraline dans le perméat puis la concentration en
(+)-sertraline dans le perméat.
Entrée de l'eau contaminée chauffée : 43 x1200 =51 600 ng / h = 51,6 µg / h.
Sortie de l'eau contaminée : 48 x1000 =48 000 ng / h = 48 µg / h.
Conservation des débits : 51,6-48=3,6 µg / h en (+)-sertraline dans le perméat.
Concentration : 3,6 / 200 =0,018 µg / L = 18 ng / L.
|
|













