Le
trans-resvératrol,
BTS métiers de la chimie.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Extraction par solvant à partir de sarments de vigne.
1. Nommer les groupes caractéristiques.
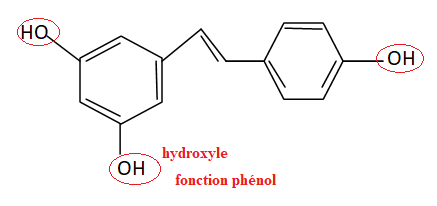 2.
2. Représenter le cis-resvératrol et préciser le lien de stéréoisomérie.
Diastéréoisomères.
 3.
3. Décrire
les interactions entre les solvants aprotiques et le trans-resvératol.
Faire de même avec les solvants protiques. Conclure.
Interactions entre les solvants protiques et le trans-resvératol : liaisons hydrogène.
Interactions entre les solvants aprotiques et le trans-resvératol : interactions très faibles de Van der Waals.
Les solvants protiques sont plus efficaces pour une exttraction que les solvants aprotiques.
Un kilogramme de sarments de vigne séchés ( taux d'humidité 4 %)
est broyé à une granulométrie de 4 mm. Ce solide est mélangé avec 7 L
d'éthanol à 95 %. L'extraction est opérée pendant 20 h à 30°C. On
obtient 280 g d'extrait brut ( teneur en trans-resvératrol 3 %). Un
travail de recherche conduit à un taux d'extraction compris entre 1 et
5 %.
4. Vérifier
que le taux d'extraction en trans- resvératrol par rapport à la masse
sèche est cohérent avec celui du travial de recherche.
Masse de solide sec : 960 g.
Masse de trans-resvératrol : 280 x 0,03 =8,4 g.
8,4 /960 =0,00875 ou environ 0,9 %, un peu inférieur à celui du travail de recherche.
5.
Un hectare de vigne génère 2 tonnes de sarments broyés. Estimer le
volume de solvant nécessaire et le coût en solvant. ( 88 € pour 5
L) .
7 L d'éthanol pour 1 kg de sarments ; 7 x 2000 = 14 000 L d'éthanol.
14 000 x88 / 5=246 400 €.Les solvants protiques sont plus efficaces pour une exttraction que les solvants aprotiques.
Synthèse.
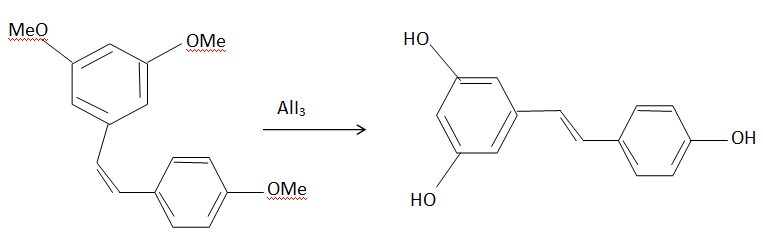
6. Préciser la sélectivité observée au cours de cette étape.
Moindre encombrement stérique pour le composé Z.
7. Préciser la nature de la réaction.
Réaction acide base entre un acide de Lewis AlI3 et un éther.
8. Quel réactif peut-on utiliser à la place de ALI3 ? AlCl3 ou PCl3.
AlCl3 acide de Lewis comme AlI3.
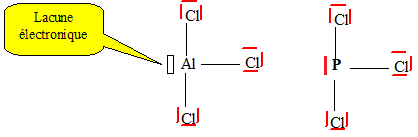
9. Identifier les deux rôles de cette étape.
Déprotection de la fonction phénol.
10. Calculer le rendement global.
Etape 1 : rendement 86 % ; étape 2 : rendement 84 %.
Rendement global : 0,86 x0,84 x100 ~ 72 %.
11. Quelles sont les précautions à prendre lors du flaconnage et pour le stockage du trans-revératrol ?
Port de gants et équipement de protection des yeux.
Stochage dans un endroit sec et frais, ventilé, en absence de comburants.
12. Proposer un
protocole pour étalonner une solution d'hydroxyde de sodium à
environ 0,2 mol / L selon un titrage par détection viduelle.
Acide chlorhydrique à 0,20 mol/ L situé dans la burette graduée.
10 mL d'hydroxyde de sodium à titrer dans un erlenmeyer.
Indicateur coloré : bleu de bromothymol. Passage du jbleu au jaune.
13. Test de Grubbs.
15 laboratoires ; valeur moyenne : 0,1781 ; écart type : 0,00267 ;
moyenne maximale = 0,1818 ; moyenne minimale = 0,1721 ;
Gmax = (0,1818 -0,1781) / 0,00267=1,386.
Gmin =(0,1781 -0,1721) / 0,00267=2,247
Valeur critique : 2,549.
Gmax et Gmin sont inférieures à 2,549, tous les résultats des laboratoires sont validés.
14. Citer deux
sources d'erreurs pouvant expliquer la différence entre les deux
valeurs de concentrations obtenues par le laboratoire 16.
C1 = 0,1526 mol / L et C2 = 0,1825 mol / L.
Erreur sur le volume de solution titrée prélevée.
Erreur de lecture du volume équivalent.
15. Compléter le tableau suivant :
Solution titrante
|
hydroxyde de sodium
|
Concentration de la solution titrante
|
0,1783 ±0,0036 mol / L
|
Volume à verser à la burette automatique
|
20 mL
|
Solution titrée
|
acide 4-méthoxy-phénylacétique |
Prise d'essai
|
m = 0,5068 g
|
Capteurs
|
sonde pH
|
Fonction tracée
|
pH =f(volume ajouté)
|
Allure
|
ascendante, un point d'inflexion
|
Axes
|
Ordonnée : pH ; abscisse : volume ajouté
|
Volume équivalent Véq = 14,32 mL.
16. Déterminer la pureté de cet acide titré.
n acide = Cb Véq =0,1783 x 14,32=2,553 mmol.
M(acide) = 166,17 g / mol.
Masse de cet acide = 166,17 x2,553 10-3 =0,424 g.
Pureté : 0,424 / 0,5068 x 100~ 83,7 %.
17. Déterminer la masse de cet acide à peser pour réellement mettre en jeu une masse d'un gramme de cet acide.
1 / 0,837 =1,195 g.
Réaction de Perkin : condensation aldolique d'un aldehyde aromatique et d'un anhydride d'acide en présence d'une base.
18. Identifier l'étape de la synthèse multi-étapes utilisant une stratégie analogue à celle de Perkin.
Etape 1.
19. Schéma légendé du chauffage à reflux.
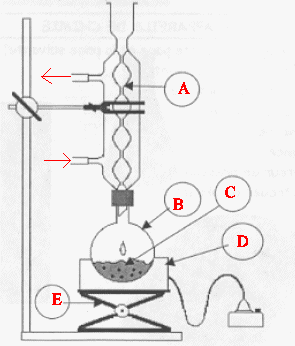
A : réfrigérant à eau ; ballon ; D
: chauffe ballon ; E : élévateur à
croisillons.
20. Justifier le rôle d'ajout d'acide chlorhydrique suite au reflux.
pKa de l'acide furylacrylique : 4,3.
A pH inférieur à 4,3, la forme acide prédomine et elle est insoluble dans l'eau.
A- + H3O+ --> AH + H2O.
21. Identifier l'éluant le pls adapté pour réaliser le suivi cinétique par CCM.
Les rapports frontaux des étalons ( furfural, acide furylacrylique) et
celui du milieu réactionnel doivent être bien différents les uns des
autres. Donc éluant 1, acétone.
22. Représenter
l'allure de la plaque CCM après prélevement du milieu réactionnel à la
fin du reflux pour une transformation totale.

23. Identifier l'inconvénient majeur d'avoir utilisé le furfural.
Le furfural est toxique, cancérogène.
24. Identifier les signaux identifiant le produit formé en IR et RMN du proton.
Spectre IR : apparition d'une large bande ( OH lié) vers 3000 cm-1.
Spectre RMN : disparition de la bande vers 9,9 ppm ( proton de
l'adehyde) et apparition des bandes relatives aux protons de la double
liaison -HC=CH-
|
| .
. |
....
|
Partie C : Production à l'aide des biotechnologies végétales.
La culture de cellules de sarments de vigne permet la bioproduction de
trans-resvératrol. Le dosage par étalonnage du trans-resvératrol dans
l'extrait sec se fait par chromatographie en phase liquide haute
performance.
Equation de la droite obtenue : A = 2,67 [resveratrol].
A : aire du pic ; [resveratrol] concentration en mg / L.
Un échantillon d'1 mL contenant 0,1 g d'extrait sec dissout dans le méthanol est analysé.
25. Expliquer le choix de la longueur d'onde de travail.
Pour une meilleure précision, on choisit la longueur d'onde correspondant au maximum d'absorption, soit environ 300 nm.
26. Donner la composition de l'éluant au moment de la détection du trans-resvératrol ( t = 4,5 min)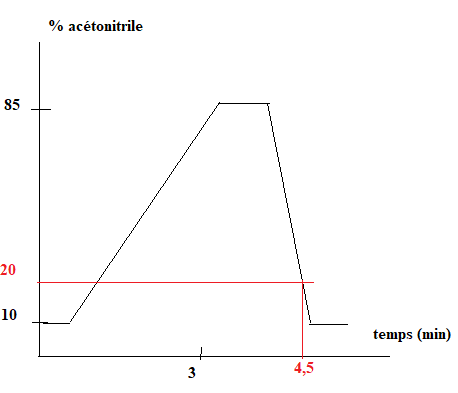
27. Compléter les schémas suivants.
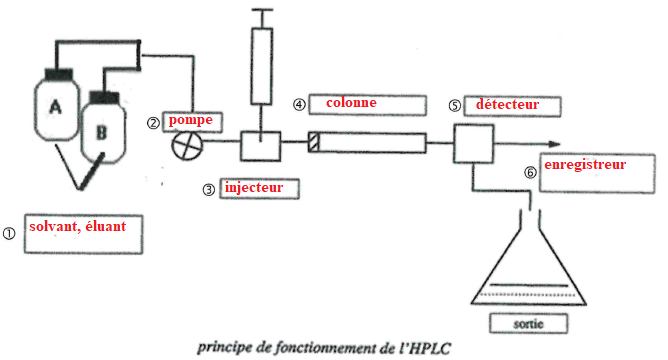
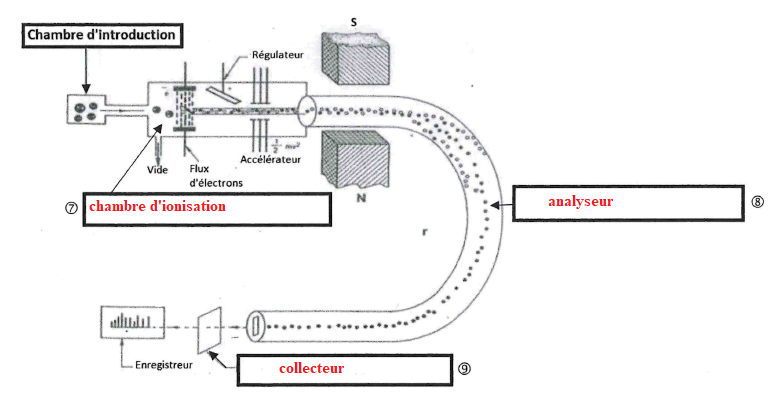
28. Déterminer la masse de trans-resvératrol contenue dans l'échantillon analysé et le rendement de cette extraction.
Aire du pic A = 7225,6 .
[resveratrol] = A / 2,67 =7225,6 /2,67 =2706 mg / L ou 2,706 mg / mL.
Un échantillon d'1 mL contenant 0,1 g d'extrait sec dissout dans le méthanol est analysé.
2,7 10-3 g / mL.
Rendement 2,7 10-3 / 0,1 x100 =2,7 %.
29. Quelles sont les avantages et inconvénients de ces trois méthodes.
Méthode 1 : matière première abondante mais volume, donc coût très élevé du solvant.
Méthode 2 : utilisation de produits chimiques dangereux et couteux.
Seule une faible partie du trans-resvératrol passe dans le plasma
sanguin et une grande majorité se retrouve dans les urines sous forme
de resvératrol-3-sulfate ou de resvératrol-3-O-glucoronide.
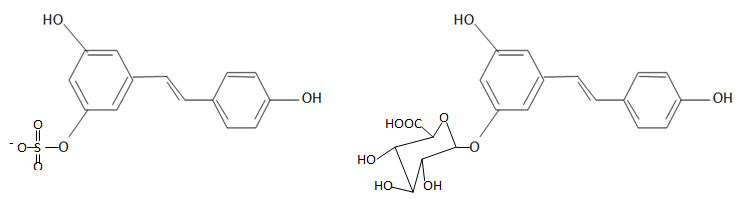
30. Préciser le type de sélectivité observée au cours de la métabolisation.
Réaction chimiosélective : parmi plusieurs groupes fonctionnels, un des groupe réagit sélectivement.
31. Justifier la grande solubilité de ces deux métabolites dans les urines.
Ces deux métabolites sont polaires comme les urines.
Les réactions biochimiques sont modélisées par la réaction du trans-resvératrol avec le radical L-OO. dans le toluène à 37°C.
Deux hypothèses sont envisagées :
Hypothèse a : Ar-OH +L-OO. -->Ar-O. +L-OOH. Energie d'activation 55,6 kJ/mol.
Hypothèse b : Ar-OH +L-OO. -->Ar-OH.+ +L-OO-. ( étape 1). Energie d'activation 395,8 kJ/mol.
Ar-OH.+ +L-OO---> Ar-O. +L-OOH.( étape 2).
32. Donner l'équation de la réaction modélisant la transformation ayant lieu dans l'hypothèse b.
Ar-OH +L-OO. -->Ar-O. +L-OOH.
33. Identifier dans cette hypothèse le ou les intermédiaires réactionnels.
Ar-OH.+ et +L-OO. .
34. Justifier que la donnée de l'énergie d'activation de l'étape 2 du mécanisme b n'est pas nécessaire.
Un intermédiaire réactionnel apparaît au cours de l'étape 1 et se trouve rapidement consommé au cours de l'étape 2.
35. Tracer le profil énergétique des deux mécanismes sans souci d'échelleet en déduire le mécanisme le plus probable.
e.
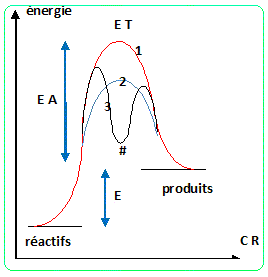
|
E T : état de transition ; CR : coordonnée
réactionnelle
EA : énergie d'activation ; E : énergie de la
réaction
# : intermédiaire réactionnel
(1) : absence de catalyseur
(2) : catalyse avec stabilisation de l'état de
transition
(3) : catalyse avec remplacement d'une réaction
lente par deux réactions plus rapides.
|
L'hypothèse a est la plus probable, l'énergie d'activation est bien inférieure à celle de l'hypothèse b.
|
|










