Mesure
du profil vertical de la concentration en SO2(g), concours
général
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Les mesures de la concentration en SO 2(g)
en fonction de l'altitude sont conduites à l'aide d'un capteur embarqué
par un ballon-sonde. Ce capteur calcule la concentration en SO 2(g) de l'air par la différence entre les intensités du courant débité par deux piles A et B.
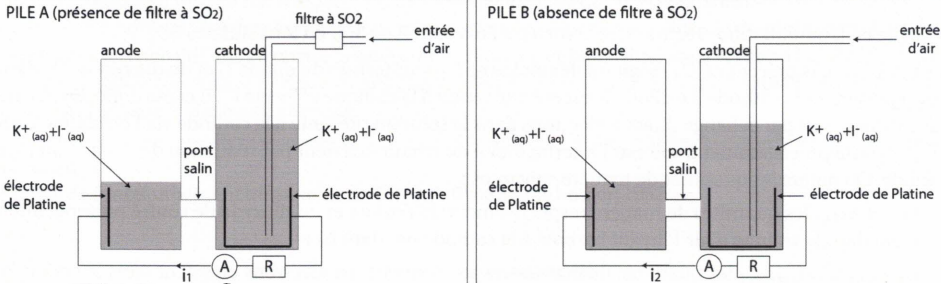 Réponse de la pile A
Réponse de la pile A.
27. Ecrire les demi-équations électroniques modélisant la transformation de O 3 en O 2 et celle de I - en I 2.
Réduction de l'ozone : O3 +2e- +2H+--> O2 +H2O.
Oxydation de I- : 2I- --> I2 +2e-.
L'échange des électrons entre les deux espèces s'effectue à la surface des électrodes.
28. Etablir l'équation de la réaction.
O3 +2e- +2H+ +2I- --> O2 +H2O+ I2 +2e-.
O3 +2H+ +2I- --> O2 +H2O+ I2 .
29. La pompe envoie de l'air en direction de la cathode avec un débit volumique constant Dv pendant une durée Dt.
Donner l'expression du volume d'air V injecté.
V = Dv Dt.
30. On note n(O3) la quantité d'ozone contenue dans ce volume d'air V. Ecrire la relation liant n(O3) et n(I2).
n(O3) = n(I2).
31. Le diiode formé réagit à la cathode pour former I -. L'apport d'électrons provient de l'anode où I - se transforme en I 3-.
Ecrire les demi-équations électroniques ayant lieu à l'anode et à la cathode. Etablir l'équation de fonctionnement de la pile.
Anode : 3I - --> I 3- + 2e -.
Cathode : I 2 +2e - --> 2I -.
3I- + I2 +2e- --> I3- + 2e-+ 2I-.
Equation de fonctionnement de la pile : I- + I2 --> I3- .
32. On note n1 la quantité de matière d'électrons circulant via le circuit extérieur. Etablir la relation entre n1 et n(O3).
n(O3) = n(I2) et n1 =2 n(I2).
n1 =2n(O3) .
33. Exprimer l'intensité du courant électrique i1.
i1= n1F / Dt =2n(O3)F / Dt .
On note C(O3)=n(O3) / V la concentration en ozone.
i1=2C(O3 )V F / Dt .
Or V / Dt = Dv.
i1=2C(O3 )Dv F.
Réponse de la pile B.
SO2 est oxydé en ion sulfate SO42-.
34. Ecrire la demi-équation correspondante.
A l'anode, oxydation SO2 +2H2O --> SO42- +4H+ +2e-.
O3 +2H+ +2I- --> O2 +H2O+ I2 .
A la cathode : I2 +2e- --> 2I-.
SO2 +2H2O + I2 +2e- --> SO42- +4H+ +2e-+2I-.
SO2 +2H2O + I2 --> SO42- +4H+ +2I-.
Le diiode capte les électrons par deux voies : échange direct dans la solution présente à la cathode via l'oxydation de SO2 et par l'intermédiaire du circuit extérieur.
On note : n(O3) et n(SO2), quantités de matière d'ozone et de dioxyde de soufre présentes dans le volume V.
n2 circuit : quantité de matière d'électrons circulant dans le circuit pendant Dt.
n2 direct : quantité de matière d'électrons échangés directement à la surface de la cathode pendant Dt.
35. Ecrire la relation liant n(I2), n2circuit et n2direct. En déduire la relation liant n(O3), n(SO2) et n2circuit.
SO2 +2H2O + I2 --> SO42- +4H+ +2I-.
n(I2) =½n2(e) =½( n2 circuit +n2 direct ).
n2 direct =2 n(SO2) ;
n(O3) =n(I2) .
n(O3) =½( n2 circuit +n2 direct )= ½n2 circuit +n(SO2).
36. Etablir la relation liant i2 circulant dans le circuit extérieur, C(O3) et C(SO2), Dv et F.
i2 = n2 circuitF / Dt =2[n(O3)-n(SO2)] F / Dt .
i2 =2[C(O3)-C(SO2)] VF / Dt .
Or V / Dt = Dv.
i2 =2[C(O3)-C(SO2)] Dv F .
37. Montrer que C(SO2) = (i1-i2) / (2DvF).
i1-i2=2C(O3 )Dv F- 2[C(O3)-C(SO2)] Dv F .
i1-i2=2C(SO2) Dv F .
C(SO2) = (i1-i2) / (2DvF).
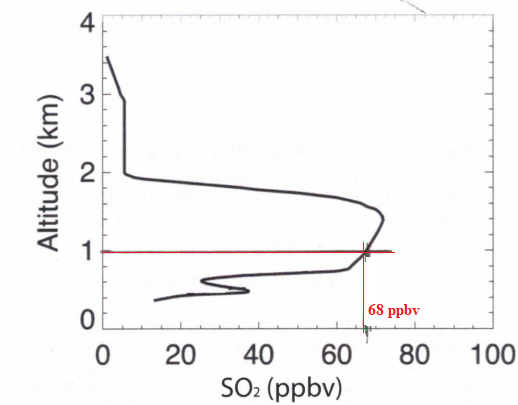
On donne Dv =220 cm3 /min ; 1 ppbv =3,83 10-8 mol m-3.
38. En déduire i1-i2, la ballon se trouvant à l'altitude h = 1 km.
Dv = 220 10-6 / 60= 3,67 10-6 m3 /s.
C(SO2)=68 x3,83 10-8=2,60 10-6 mol m-3.
i1-i2=2C(SO2) Dv F =2 x2,60 10-6 x3,67 10-6x96500=1,8 10-6 A.
|
...
|
....
|
Polution atmosphérique au SO2 à Londre en 1952.
.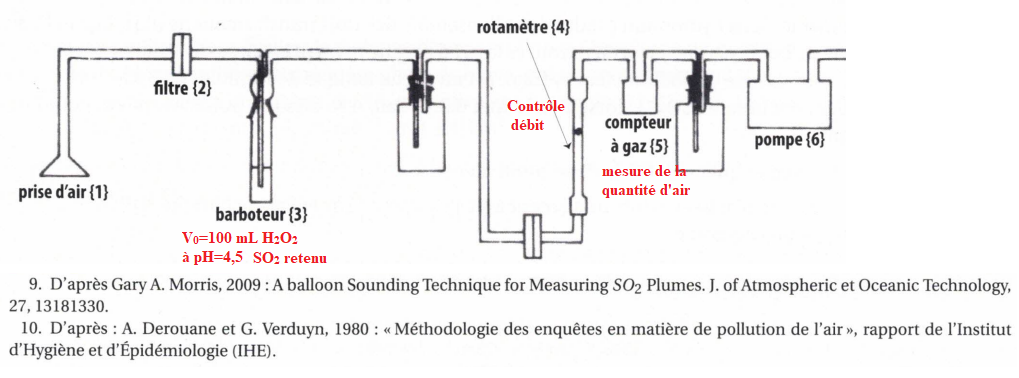
Dans le barboteur : SO2(g) + H2O --> H2SO3 aq (1).
39. Construire le diagramme de prédominance associé à l'acide sulfureux.

40. Ecrire l'équation de la réaction qui transforme l'acide sulfureux en cette forme majoritaire.
H2SO3 aq = HSO3-aq + H3O+aq. (2).
41. Ecrire l'équation de la réaction entre l'eau oxygénée en excès et cette forme majoritaire.
H2O2aq +2H+aq +2e- --> 2H2O(l).
HSO3-aq +H2O(l)--> SO42-aq +3H+aq +2e-.
H2O2aq +2H+aq +2e- +HSO3-aq +H2O(l)--> 2H2O(l) + SO42-aq +3H+aq +2e-.
H2O2aq +HSO3-aq --> H2O(l) + SO42-aq +H+aq .(3).
V(z) =mHe Mair./
(MHe µair(z))=1,83 103 x 29,0 / (4,00
x0,30)=4,4 104 m3 < 19,6 104 m3
= Vmax.
42. En combinant ces trois équations on trouve :
(1) +(2) donnent : SO2(g) + H2O (l)= HSO3-aq + H3O+aq.
(1) +(2)+(3). donnent : SO2(g) + H2O2aq = SO42-aq +2H+aq .
43. Relier n(SO2) dissout à n(H+aq).
n(SO2) =½n(H+aq).
44. Calculer n(H+aq) présent dans le barboteur quand tout le dioxyde de soufre a réagi.
Initial : n(H+aq) i=V0 10- 4,5.
Final : n(H+aq) =V0 10- pH.
n(H+aq)=2n(SO2)+V0 10- 4,5.
45.
Expliquer pourquoi on ne peut pas réaliser un tosage acido-basique
traditionnel avec une solution de soude pour quantifier la quantité de
SO2.
L'air contient du dioxyde de carbone qui se dissout en partie dans l'eau.
Un titrage traditionnel dosera à la fois SO2 et CO2 dissouts.
On ajoute au volume V0 un certain volume de borax Na2B4O7,10H2O,afin d'éliminer les ions hydronium produits par l'ensemble des trois transformations
(1) +(2)+(3).
Cet ajout permet de retrouver le pH d'origine fixé pH = 4,5. Le borax s'hydrolyse et forme une solution tampon.
46. Ecrire l'équation de dissolution du borax.
Na2B4O7,10H2O (s)--> 2Na+aq + B4O72-aq +10H2O(l).
47. Les ions borate réagissent totalement avec l'eau et forme l'acide borique H3BO3 et sa base conjuguée B(OH)4- selon :
B4O72-aq +7H2O(l) --> 2H3BO3 aq +2B(OH)4- aq.
Déterminer le pH de cette solution..
pKa( H3BO3 aq / B(OH)4- aq) = 9,2.
[H3BO3 aq ] = [B(OH)4- aq] ; pH = pKa = 9,2.
48. Citer 2 propriétés d'une solution tampon..
Une solution tampon modère les variations de pH suite à l'ajout modéré d'un acide ou d'une base, suite à une dilution modérée.
On
prépare une solution de borax en ajoutant m=38 mg de borax dans 1,0 L
d'eau. Il faut ajouter à la solution du barboteur, V = 9,4 mL de
cette solution pour qu'elle retrouve son pH initial.
49.
La pompe électrique a un débit d'air de 3,0 L /min, la solution d'eau
oxygénée avait été laissée en place pendant 15 min. En déduire la
concentration du dioxyde de soufre dans l'air.
n =n(H3BO3 aq) =n(B(OH)4- aq) dans 9,4 mL de solution de borax.
n =2 m V / M(borax) =2 x 0,038 / 381,2 x 9,4 10-3=1,87 10-6 mol.
Les ions hydronium produits par SO2 réagissent avec B(OH)4- aq afin de retrouver le pH initial 4,5.
SO2(g) + H2O2aq = SO42-aq +2H+aq .
n(H+aq)=2n(SO2).
B(OH)4- aq +H+aq -->H3BO3 aq +H2O(l).
n(B(OH)4- aq) =n- 2n(SO2) ; n(H3BO3 aq) = n+2n(SO2).
[B(OH)4- aq] = (n- 2n(SO2)) / (V+V0) ; [H3BO3 aq] = (n+ 2n(SO2)) / (V+V0) ;
Ka = [H+aq] [B(OH)4- aq] / [H3BO3 aq] = 10-pH (n- 2n(SO2)) / (n+ 2n(SO2)).
(n+ 2n(SO2))Ka =10-pH (n- 2n(SO2)).
2n(SO2) (Ka +10-pH )=n(10-pH - Ka).
n(SO2) =0,5 x 1,87 10-6 x(10-4,5 -10-9,2) / (10-4,5 +10-9,2)=9,37 10-7mol = 0,937 µmol.
Volume d'air : 3,0 x15 = 45 L=0,045 m3.
Concentration en SO2 : 0,937 / 0,045=20,8 µmol m-3.
20,8 x M(SO2) =20,8 x64 = 1332 g m-3 ~ 1,3 mg m-3.
Cette concentration s'est maintenue pendant au moins 6 jours consécutifs.
Limite journalière : 0,125 mg m-3 à ne pas dépasser plus de 3 jours par an.
Le seuil d'alerte est largement dépassé.
|
|