Chimie,
concours
Police Technique et Scientifique 2022.
( zone Sud Est)
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Question
1 : L’élément carbone est caractérisé par un numéro atomique Z égal à :
A. 6 vrai ; B. 8 ; C. 12.
Question 2 : La masse molaire moléculaire est la masse :
A) d’une mole de molécules vrai
B) d’une mole d’atomes
C) d’1g de molécules
D. est un alcool primaire.
Question 3 : Une molécule d’alcool possède un groupe :
A) carbonyle
B) hydroxyle vrai
C) carboxyle
Question 4 : Pour une extraction liquide-liquide on utilise :
A) une burette
B) une ampoule à décanter vrai
C) un erlenmeyer.
Question
5 : L’acide éthanoïque CH3COOH a la propriété de pouvoir :
A) capter un proton H+
B) céder un proton H+ vrai
C) céder un groupement hydroxyle OH-.
Question 6 : L’atome d’oxygène de configuration électronique 1s22s22p4 possède :
A) 8 électrons de valence
B) 6 électrons de valence vrai
C) 4 électrons de valence
Question 7 : Dans la théorie VSEPR la molécule d’eau est de type :
A) AX2E0 ; B) AX2E2 vrai; C) AX4E0.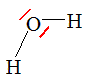
Question 8. Soit une solution à 2,5.10-1 mol.L-1
de sulfate de fer. On effectue une dilution en pipetant 10 mL de cette
solution que l’on verse dans une fiole jaugée de 100 mL, complétée avec
de l’eau distillée.
Quelle est la concentration en quantité de matière de la solution diluée ? :
A) 2,5.10-2 mol.L-1 vrai ( facteur de dilution 100 / 10 = 10)
B) 2,5.10-3 mol.L-1 ; C) 0,25 mol.L-1.
Question 9 : Deux noyaux isotopes ont un nombre égal de :
A) neutrons ; B) nucléons : C) protons vrai.
Question 10. La masse molaire de l’acide formique de formule brute CH2O2 est de :
A) 46 g.mol-1 vrai; B) 40 g.mol-1 ; C) 32 g.mol-1. ( 12 +2 +2 *16=46).
Question 11. La formule de Lewis d’une molécule représente les liaisons entre atomes ainsi que :
A) les doublets n non liants vrai
B) les interactions de Van Der Waals
C) les liaisons hydrogène.
Question 12. Parmi les molécules suivantes laquelle est apolaire :
A) HCl ; B) H2O ; C) CH4 vrai ( du fait de la symétrie tétraèdrique)
Question 13. Le pH d’une solution d’acide fort de concentration c peut être calculé selon la formule suivante :
A) pH = - log 1/c ; B) pH = - log c vrai ; C) pH = 1 – log c.
Question 14. Le pH d’une solution tampon est égal :
A) au pka du couple Acide / Base vrai.
B) au Ka du couple Acide / Base
C) au pke de l’eau.
Question 15. L’ion Fe2+ a la propriété de se transformer en Fer métallique par un phénomène de :
A) réduction vrai ; B) oxydation ; C) hydratation
Question 16. Quelle est la représentation topologique de l’urée ?
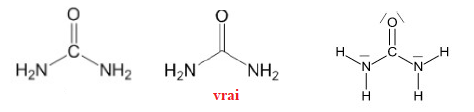
Question 17. La molécule de formule semi-développée suivante se nomme :
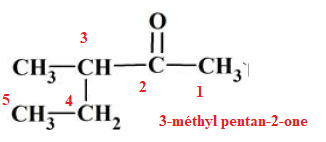
A) 3-éthylpentan-2-one
B) 3-éthylpentane-4-one
C) méthylhexanone.
Question 18.
A l’aide d’un spectrophotomètre on mesure l’absorbance A d’une solution
de sulfate de fer A = 0,244. Quelle sera l’absorbance d’une solution de
sulfate de fer 2 fois moins concentrée ?
A) 0,244
B) 0,122 vrai ( absorbance et concentration sont proportionnelles)
C) 0,06.
Question 19. En spectroscopie infrarouge (IR), la bande d’absorption caractéristique d’un groupe carboxylique est :
A) 2600 – 3800 cm-1 ; B) 1700 – 1760 cm-1 vrai ; C) 3200 – 3400 cm-1.
Question 20. Lors d’un dosage suivi par indicateur coloré, que se passe-t-il lorsque pH > pka + 1 ?
A) la solution prend la couleur de la forme basique de l’indicateur coloré vrai
B) la solution prend la couleur de la forme acide de l’indicateur coloré
C) la solution prend une couleur intermédiaire
|
...
|
....
|
Un
éthylotest à usage unique met en jeu une réaction d’oxydoréduction
entre des ions dichromates(en milieu acide) et l’éthanol expiré : au
contact des ions dichromate Cr2O72-,
l’éthanol sera oxydé en acide acétique. Les ions dichromate, de couleur
orange, se transformeront en ions Chrome (III) de couleur verte.
1. Définissez un réducteur.
Un réducteur est une espèce susceptible de céder un ou plusieurs électrons.
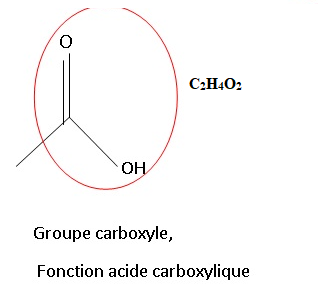
2. L’acide acétique est également appelé acide éthanoïque. Donnez sa formule brute et sa formule topologique.
3. Donnez la demi-réaction d’oxydoréduction du couple Cr2O72- /Cr3+, puis celle du couple Ethanol/Acide acétique.
4. En déduire la réaction entre l’ion dichromate et l’éthanol en milieu acide.
2 fois {Cr2O72- + 14H+ + 6e- = 2Cr3++ 7H2O.}
3 fois {CH3CH2OH +H2O = CH3COOH +4H+ + 4e-}.
Ajouter et simplifier :
2Cr2O72- + 28H+ + 12e- +3CH3CH2OH +3H2O= 4Cr3++ 14H2O +3CH3COOH +12H+ + 12e-.
2Cr2O72- + 16H+ +3CH3CH2OH = 4Cr3++ 11H2O +3CH3COOH .
Le
tube en verre de l’éthylotest contient de la poudre de dichromate de
potassium. A l’aide d’un spectrophotomètre, nous souhaitons déterminer
la quantité de dichromate de potassium dans un alcootest. Pour ce
faire, la poudre du tube en verre est dissoute dans un volume d’eau
distillée de
50 mL : on obtient la solution S.
5. À quelle longueur d’onde faut-il régler le spectrophotomètre ?
6. Justifiez la couleur jaune-orangée de la solution S.
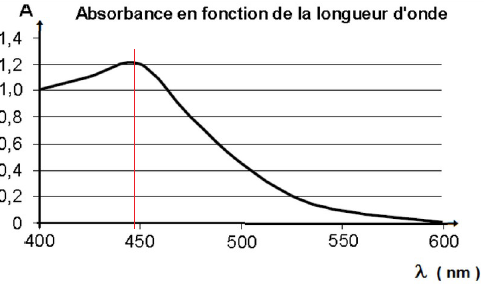
Pour une meilleur précision, on se place au maximum d'absorption, soit vers 450 nm ( couelur bleu, bleu indigo).
La solution possède la couleur complémentaire du bleu indigo, soit le jaune orangé.
A l’aide de solutions commerciales diluées de dichlorate de potassium disposées dans des cuves de
l=1cm, à lambda fixe, on recense les données suivantes :
C ( x 10-4) mol / L
|
0
|
0,5
|
1
|
2
|
4
|
A
|
0
|
0,1
|
0,2
|
0,4
|
0,8
|
| C / A ( x 10-4) |
xx
|
5
|
5
|
5
|
5
|
7. Rappelez la loi de Beer-Lambert. Est-elle vérifiée ?
Pour de faibles concentrations, l'absorbance A est proportionnelle à la concentration C.
C / A = constante, cette loi est bien vérifiée.
8. La solution S est analysée à la même longueur d’onde. L’absorbance mesurée est As = 0,68. Déterminez la concentration Cs.
Cs = 5 x0,68 10-4 =3,4 10-4 mol / L.
9. La masse
théorique de dichlorate de potassium dans un éthylotest est de 5 mg.
Calculez la masse de l’échantillon dissout et comparez à la valeur
théorique.
3,4 10-4 x 0,050=1,7 10-5 mol.
M(dichromate de potassium) =294 g / mol ; 1,7 10-5 x294 ~ 5,0 10-3 g ou 5 mg.
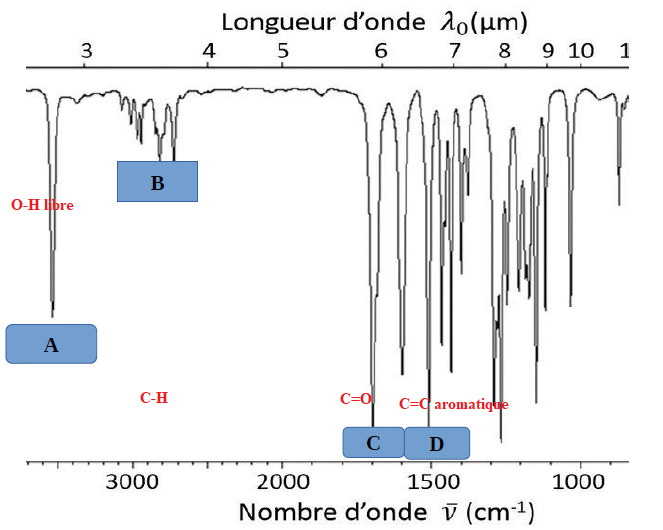
Spectrometrie IR
L’analyse par spectrometrie IR d’une molécule donne le spectre suivant.
1. Déterminez les liaisons correspondantes aux pics ci-dessous.
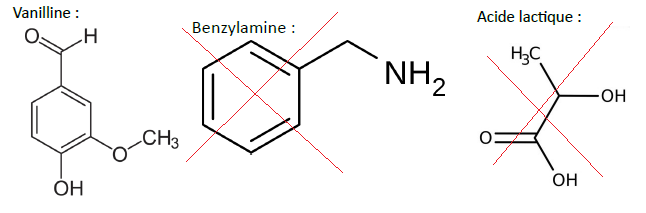
2. Parmi les molécules suivantes, déterminez laquelle correspond au spectre IR cidessus.
|
|