Chimie,
concours
Police Technique et Scientifique 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Partie 1 : La radioactivité
La datation au carbone 14, connue depuis 1950 permet d’estimer
l’âge d’un matériau organique tel que le bois, l’os, le cheveu,
certaines fibres de tissu, c’est-à-dire de la matière autrefois vivante.
Question 59 : (1 point)
Le carbone 14 est un isotope du carbone 12 ayant pour symbole : 126C. Donner la définition du terme isotope.
A. Les isotopes ont un même nombre de neutrons, mais un nombre de protons différents.
B. Les isotopes ont un même nombre de protons, mais un nombre de nucléons différents. Vrai
C. Les isotopes ont un même nombre d’électrons mais un nombre de protons différents.
D. Les isotopes ont un même nombre de nucléons et un même nombre d’électrons.
Question 60 : (1 point)
Quelle est la composition du noyau de carbone 12 de symbole 126C ?
A. 12 neutrons et 6 nucléons.
B. 6 nucléons et 12 électrons.
C. 6 protons et 6 neutrons. Vrai.
D. 6 électrons et 12 protons.
Question 61 : (1 point)
Quelle est la particularité des gaz nobles ou rares dans la
classification périodique des éléments et dans quelle colonne se
situent-ils ?
A. Les gaz nobles ou rares
se situent dans la dernière colonne de la classification périodique et
sont inertes chimiquement. Vrai.
B. Les gaz nobles ou rares se situent dans la première colonne de la
classification périodique et réagissent avec d’autres éléments
chimiques.
C. Les gaz nobles ou rares se situent dans la première colonne de la classification périodique et sont inertes chimiquement.
D. Les gaz nobles ou rares se situent dans la dernière colonne de la
classification périodique et réagissent avec d’autres éléments
chimiques.
Question 62 : (1 point)
Quelle est la particularité des halogènes dans la classification périodique des éléments et dans quelle colonne se situent-ils ?
A. Ils se situent dans la première colonne de la classification périodique et libèrent facilement un électron.
B. Ils se situent dans l’avant-dernière colonne de la classification périodique des éléments et libèrent facilement un électron.
C. Ils se situent dans la première colonne de la classification périodique et captent facilement un électron.
D. Ils se situent dans l’avant-dernière colonne de la classification périodique et captent facilement un électron. Vrai.
Question 63 : (1 point)
Quelle est la configuration électronique de l’atome de carbone de symbole 126C ?
A. 1s2 2s2 2p6 3s2
B. 1s2 2s2 2p2 vrai.
C. 1s2 2s2 2p4
D. 1s2 2s2 2p6
Lors de fouilles dans la ville de Marseille en 1993,
deux navires d’époque grecque archaïque ont été retrouvés. D’après des
recherches historiques, ils auraient coulé en 545 avant JC. L’analyse
d’un échantillon d’un gramme de carbone d’un de ces navires montre une
activité liée à la présence du carbone 14 égale à 9,94 Bq.
Question 64 : (1 point)
Définir l’activité A d’un échantillon.
A. L’activité A d’un échantillon est le nombre moyen de désintégrations se produisant par seconde. vrai.
B. L’activité A d’un échantillon est le nombre moyen de noyaux radioactifs restant dans l’échantillon.
C. L’activité A d’un échantillon est le nombre moyen de désintégrations se produisant pour une période radioactive.
D. L’activité A d’un échantillon est le nombre moyen de noyaux radioactifs restant dans l’échantillon au bout d’une période.
Question 65 : (1 point)
Définir le temps de demi-vie du carbone 14.
A. La demi-vie est la durée au bout de laquelle tous les noyaux radioactifs se sont désintégrés.
B. La demi-vie correspond à la moitié du nombre de noyaux initialement présents.
C. La demi-vie est la
durée au bout de laquelle la moitié du nombre des noyaux radioactifs
initialement présents se sont désintégrés. Vrai.
D. La demi-vie correspond à la durée où tous les noyaux se sont totalement désintégrés.
Question 66 : (1 point)
Un échantillon dans lequel s’effectuent 600 désintégrations radioactives par minute a une activité égale à :
A. 600 Bq
B. 10 Bq vrai
C. 3,6 ×104 Bq
D. 100 Bq.
600 / 60 = 10 Bq.
Question 67 : (1 point)
Le carbone 14C est un noyau radioactif émetteur β-.
Indiquer la réaction nucléaire correspondant à sa désintégration. On
admet que le noyau fils n’est pas obtenu dans un état excité.
A. 146C --> 104Be +42He
B. 146C --> 147N +0-1e vrai
C. 146C --> 145B +01e
D. 146C --> 156C +-10ß.
Question 68 : (1 point)
Quelle est la loi vérifiée par l’activité d’un échantillon ?
A. A(t) = -1 / l dN(t) /dt.
B. A(t) = d N(t ) / dt
C. A(t) = - d N(t) / dt vrai
D. A(t) = - l × d N(t) / dt.
Question 69 : (1 point)
Quelle est l’expression de l’activité A(t) en fonction du temps t et de la constante radioactive l ?
A. A(t) = A0 ×exp(−t / l).
B. A(t) = A0 / l exp(−t ).
C. A(t) = A0 ×exp( t l).
D. A(t) = A0 ×exp( -t l). vrai.
Question 70 : (1 point)
Quelle relation lie la constante radioactive et le temps de demi-vie t1/2 ?
A. t½ = -l ln(2).
B. t½ = - ln(2) / l.
C. t½ = ln(2) l.
D. t½ = ln(2) / l. Vrai.
Question 71 : (1 point) Quelle est la durée séparant le naufrage des navires et la prise de mesure ?
Rappel de l’énoncé :
Lors de fouilles dans la ville de Marseille en 1993, deux navires d’époque grecque archaïque ont été
retrouvées. D’après des recherches historiques, ils auraient été coulés en 545 avant JC.
L’analyse d’un échantillon d’un gramme de carbone d’un de ces navires montre une activité liée à la
présence du carbone 14 égale à 9,94 Bq.
Données :
Demi-vie du carbone 14 : t1/2 = 5 734 ans.
L’activité d’un échantillon d’un gramme de carbone 14 issu de la matière vivante : A0 = 13,60 Bq.
A. 899 ans
B. 1 798 ans
C. 18 998 ans
D. 2 593 ans. Vrai.
l= ln2 / 5734=1,21 10-4 an-1.
9,94 = 13,60 exp(-1,21 10-4 t) ; 0,731 =exp(-1,21 10-4 t) ; ln(0,731) = -1,21 10-4 t ; t = 2593 ans.
Question 72 : (1 point)
Pour une datation réalisée à partir d’un isotope radioactif, le temps de demi-vie de cet isotope doit-être :
A. Beaucoup plus grand que l’âge estimé de l’échantillon.
B. Beaucoup plus petit que l’âge estimé de l’échantillon.
C. Du même ordre de grandeur que l’âge estimé de l’échantillon. Vrai.
D. Cela n’a pas d’importance.
|
...
|
....
|
Partie 2 : Chimie organique
Question 73 : (1 point)
Dans la molécule 2-méthylhexanoate d’éthyle quel est le groupe caractéristique ?
A. carbonyle
B. carboxyle. Vrai fonction ester.
C. hydroxyle
D. amine.
Question 74 : (1 point)
Parmi les propositions suivantes, trouvez celle qui est exacte.
A. Le composé suivant est le 3-méthylbutane :
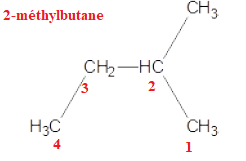
B. C5H12 est un alcane Vrai CnH2n+2 avec n = 5.
C. Le composé suivant est le 3-méthylpent-3-ène.
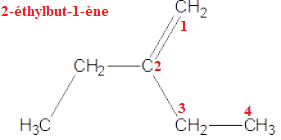
D. Le composé suivant comporte une fonction cétone dans sa structure.
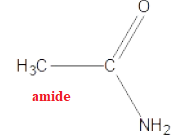
Question 75 : (1 point)
Parmi les propositions suivantes, trouvez celle qui est exacte.
A. Le composé suivant est l'acide 2-propylbutanoïque.
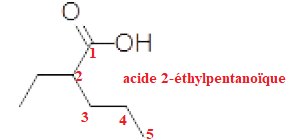
B. Le composé suivant est l'hexan-1-one.
H3C-CH2-CH2-CH2-CH2-CHO. hexanal.
C. HOCH2CH3 est un alcool primaire vrai.
D. HOCH2CH3 est un alcool secondaire.
Question 76 : (1 point)
Pour les molécules A et B suivantes, quelle affirmation est exacte?
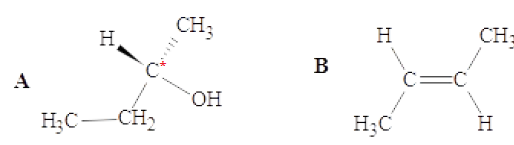
A. Elles sont toutes les deux chirales
B. A est achirale, B est chirale
C. A et B sont isomères
D. A est chirale, B est achirale. Vrai
Question 77 : (1 point)
La molécule suivante comporte :
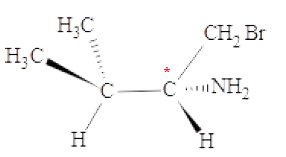
A. Aucun atome de carbone asymétrique
B. 1 atome de carbone asymétrique vrai
C. 2 atomes de carbone asymétriques
D. C’est une forme mésomère.
Question 78 : (1 point)
Ces deux molécules constituent :
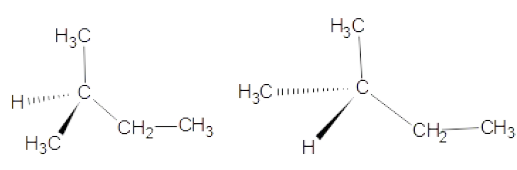
A. Un couple de molécules identiques vrai
B. Un couple d’énantiomères
C. Un couple de diastéréoisomères
D. C’est une forme mésomère.
Question 79 : ( 1 point)
Le spectre Infra-rouge suivant peut-il correspondre à la molécule de glycine ?
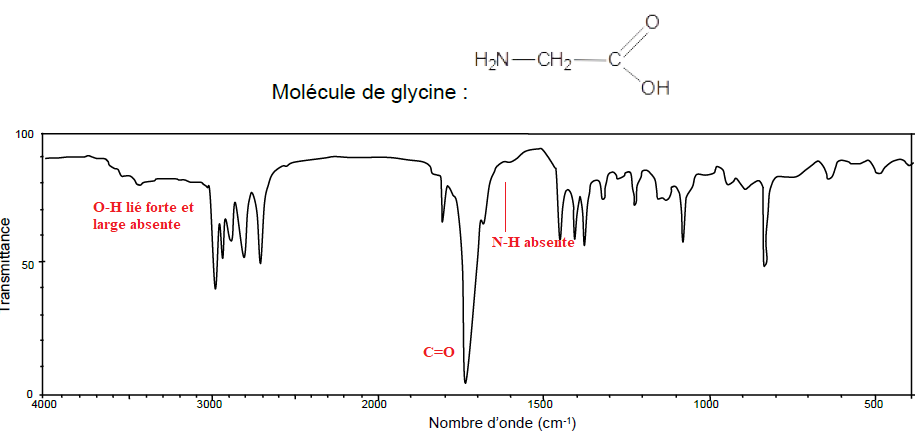
A. Oui car le spectre indique une forte transmission due à la liaison C=0 de l’acide carboxylique
B. Oui car le spectre indique une forte absorption due à la liaison O-H de l’alcool
C. Non vrai
D. Oui car le spectre indique une forte absorption due à la liaison C=0 de l’acide carboxylique.
Question 80 : (1 point)
Lors d’un titrage, on utilise la méthode des tangentes pour trouver le volume équivalent en cas de titrage :
A. spectrophotométrique
B. pH-métrique vrai
C. colorimétrique
D. conductimétrique.
Partie 3 : Chimie des solutions
Un automobiliste, un peu alcoolisé, est au volant d’une voiture à moteur essence.
On considère que l’essence est composée uniquement d’octane, de formule brute C8H18 (l), et que sa combustion dans le moteur avec le dioxygène de l’air O2 (g) produit uniquement du dioxyde de carbone CO2 (g) et de la vapeur d’eau H2O (g) selon une transformation totale.
Question 81 : (1 point)
Écrire l’équation de la réaction.
A. C8H18 (l)+ O2 (g) --> CO2 (g) + H2O (g)
B. C8H18 (l)+ 12,5O2 (g) --> 8CO2 (g) + 9H2O (g)
C. 2C8H18 (l)+ 25O2 (g) --> 16CO2 (g) + 18H2O (g) vrai
D. 8C8H18 (l)+ 2O2 (g) --> 2CO2 (g) + 2H2O (g).
Question 82 : (1 point)
Quel est le réactif limitant de cette réaction ?
A. Le dioxygène de l’air O2 .
B. L’essence, c’est-à-dire l’octane. Vrai
C. Le dioxygène de l’air et l’essence sont tous les deux réactifs limitants.
D. Cette réaction n’a pas de réactif limitant.
Question 83 : ( 1,5 point)
La voiture consomme en moyenne 4,60 L d’essence pour 100 km.
Calculer la quantité de matière n d’octane consommée.
Données : masse volumique de l’octane ρ(octane)= 703 g.L-1
M (octane)= 114 g.mol-1.
A. 1,74.104 mol
B. 6,17 mol
C. 3,52.10-2 mol
D. 28,4 mol. Vrai.
Masse d'octane : 4,6 x703 =3233,8 g.
n = m / M = 3233,8 / 114 =28,4 mol.
Question 84 : ( 1,5 point)
La
quantité de matière de dioxyde de carbone formée au cours de la
combustion de l’essence est égale à 230 mol, calculer la masse de
dioxyde de carbone formée.
Donnée : M(CO2)= 44,0 g. mol-1.
A. 10,1 kg vrai
B. 5,23 g
C. 10,1 g
D. 1,91.10-1 g.
230 x44=10 120 g= 10,1 kg.
En réalité, la combustion de l’essence est incomplète et conduit à des
émissions de gaz polluants, comme des oxydes d’azote NOx. Ces gaz
passent par le pot d’échappement ou pot catalytique et sont transformés
en gaz moins polluants.
Question 85 : (1 point)
Les catalyseurs présents dans le pot catalytique sont des métaux précieux tels que le palladium, le rhodium ou le platine .
Ces catalyseurs :
A. Augmentent la quantité finale des produits formés.
B. Accélèrent la réaction chimique des gaz polluants.
C. Modifient l’état final du système chimique. Vrai
D. Diminuent la quantité finale des produits formés.
Question 86 : (1,5 point)
Le monoxyde d’azote de formule NO est un de ces gaz polluants. Il peut réagir avec le dihydrogène suivant l'équation bilan:
2 NO (g) +2 H2 (g) --> N2 (g) + 2 H2O (g)
La vitesse volumique de disparition du monoxyde d’azote est égale à :
A. v (NO)=−½d[ NO] / dt
B. v (NO)=2. d [NO] / dt
C. v (NO)=−d[ NO] / dt. Vrai
D. v (NO)=d [ NO] / dt.
Sur son chemin, l’automobiliste est soumis à un contrôle routier et
doit réaliser un éthylotest à usage unique, compte tenu de son ébriété.
L’air expiré par l’automobiliste passe dans un tube contenant l’ion
dichromate Cr2O72- aq qui réagit avec l’éthanol de formule brute C2H6O.
Cr2O72- aq +14H+aq +6e- = 2 Cr3+aq +7 H2O(l)
Question 87 : ( 1,5 point)
Déterminer la demi-équation électronique associée au couple de l’éthanol C2H4O2 (aq) / C2H6O (aq)
A. C2H6O (aq) +2 H20 (l) = C2H4O2 (aq)+ 4 H+ (aq) + 4 e-.
B. C2H6O (aq) + H20 (l) = C2H4O2 (aq)+ 4 H+ (aq) + 4 e-. Vrai.
C. C2H6O (aq) = C2H4O2 (aq)+ 24 H+ (aq) + 2 e-.
D. C2H6O (aq) + H20 (l) = C2H4O2 (aq)+ 2 H+ (aq) + 2 e-.
Question 88 : ( 1,5 point)
En déduire l’équation de la réaction d’oxydo-réduction produite dans l’éthylotest.
3 fois { C2H6O (aq) + H20 (l) = C2H4O2 (aq)+ 4 H+ (aq) + 4 e- }
2 fois { Cr2O72- aq +14H+aq +6e- = 2 Cr3+aq +7 H2O(l) }.
Ajouter et simplifier:
3C2H6O (aq) + 3H20 (l) +2Cr2O72- aq +28H+aq +12e-= 3C2H4O2 (aq)+ 12 H+ (aq) + 12 e- +4 Cr3+aq +14 H2O(l).
3C2H6O (aq) +2Cr2O72- aq +16H+aq = 3C2H4O2 (aq)+4 Cr3+aq +11 H2O(l).
Réponse A.
Question 89 : ( 1 point)
L’automobiliste présente tout à coup des difficultés respiratoires. Il
est conduit aux urgences et la mesure de son pH sanguin donne pH=7,20.
Calculer la concentration en quantité d’ion oxonium, H3O+ du sang de l’automobiliste.
A. 1,97 mol.L-1
B. 1,58.107 mol.L-1
C. 6,31.10-8 mol.L-1 vrai
D. 8,57.10-1 mol.L-1.
10-7,2 = 6,31.10-8 mol.L-1.
Question 90 : ( 1,5 point)
Cet automobiliste est en acidose, pH<7,35. La diminution du pH est
ici anormale. Un des processus de régulation du pH est l’intervention
du système tampon sanguin (CO2, H2O)/ HCO3- dont le pKa=6,10 grâce à la réaction équilibrée suivante :
(CO2, H2O)+ H2O(l) = HCO3- (aq) + H3O+(aq)
Calculer le rapport [HCO3- (aq)] / [(CO2,H2O)] à pH =7,20.
A. 1,1.
B. 7,94.10-2.
C. 12,6. Vrai.
D. 4,14.10-2.
Ka = [HCO3- (aq) ] [H3O+(aq)] / ([(CO2, H2O)]).
[HCO3- (aq)] / [(CO2,H2O)] = Ka / [H3O+(aq)] = 10-6,1 / 10-7,2=101,1 =12,6.
Question 91 : ( 1 point)
Lorsque la concentration en dioxyde de carbone dans le sang diminue. Le pH sanguin :
A. diminue car le rapport [HCO3- (aq)] / [(CO2,H2O)] diminue
B. diminue car le rapport [HCO3- (aq)] / [(CO2,H2O)] augmente
C. augmente car le rapport [HCO3- (aq)] / [(CO2,H2O)] diminue
D. augmente car le rapport [HCO3- (aq)] / [(CO2,H2O)] augmente. Vrai.
[HCO3- (aq)] / [(CO2,H2O)] = Ka / 10-pH.=10-6,1+pH.
|
|