Chimie.
1.1 Qu'appelle t-on solution aqueuse ?
Une solution est un mélange homogène composé d'un solvant et d'un ou
plusieurs solutés. Une solution aquueuse est une solution dans laquelle
le solvant est l'eau.
1.2. Que veut dire
l'abréviation pH en chimie ?
Potentiel hydrogène.
1.3. Nommer les
molécules suivantes :
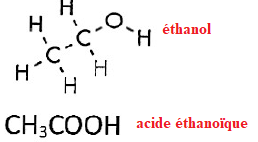 1.4 et 5.
1.4 et 5. Préciser la configuration
R ou S de la molécule de L-alanine.
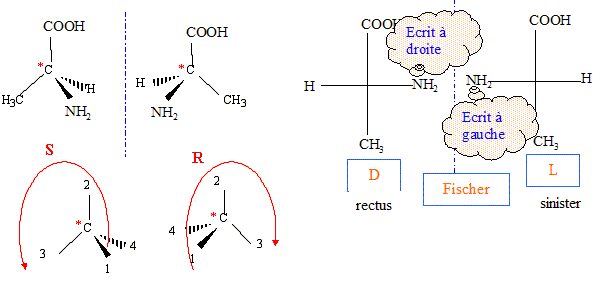
numéroter de façon décroissante chacun des quatre
substituants selon son numéro atomique.
NH2 (1) ; COOH (2) ; CH3 (3) ; H
(4).
On place alors l'atome (ou le groupement) de numéro le
plus élevé derrière.
On regarde dans quel sens, sens horaire ou
trigonométrique, on passe du numéro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou
anti-trigonométrique), le carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou
anti-horaire), le carbone est Sinister (S).
2. On a déposé sur
une feuille
de papier deux échantillons de colorants codés E131 et E132 ainsi qu'un
échantillon d'encre de stylo bille inconnu noté V. La feuille est
poositionnée verticalement dans un bocal fermé et rempli d'eau salée de
sorte que le bas de la feuille trempe dans l'eau salée mais pas la
ligne des dépôts.
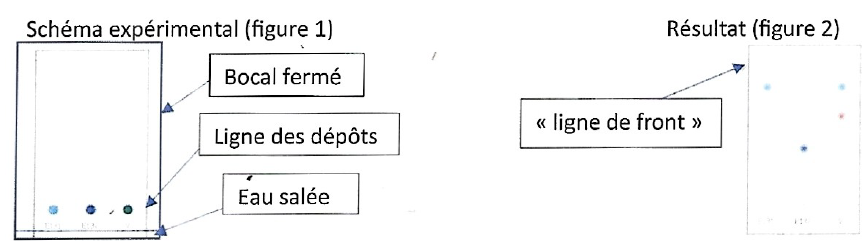 2.1.
2.1.
Comment se nomme cette technique ?
Chromatographie sur couche mince ( CCM).
2.2 Proposer un
compte-rendu d'analyse pour l'encre V.
L'encre renferme deux espèces dont l'une est le colorant E131 ( même
rapport frontal).
L'encre ne contient pas le colorant E132.
On donne le spectre UV-visible du permanganate de potassium.
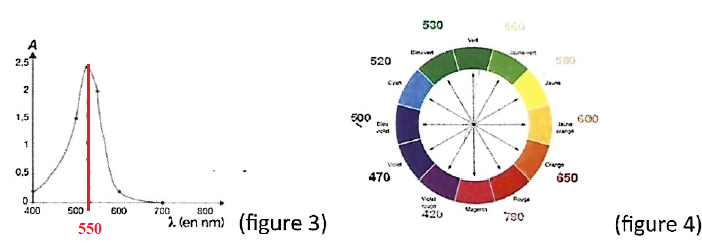 2.3
2.3 Quel est le nom
de l'appareil utilisé pour obtenir ce spectre ?
Spectrophotomètre UV visible.
2.4 Quelle est la
couleur du permanganate de potassium ?
Le maximum d'absorption se situé vers 550 nm( jaune vert). Le
permanganate de potassium possède la couleur complémentaire du
jaune vert soit le violet.
2.5 Associer les
spectres IR ci-dessous aux molécules de la question 1.3.
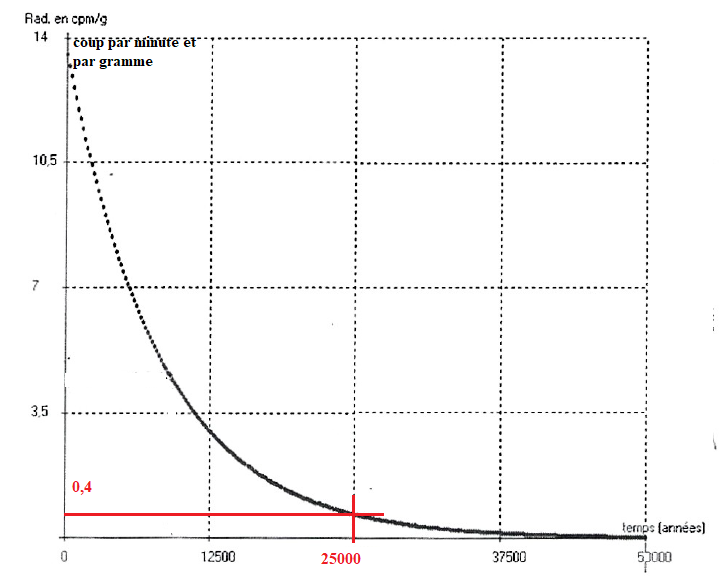
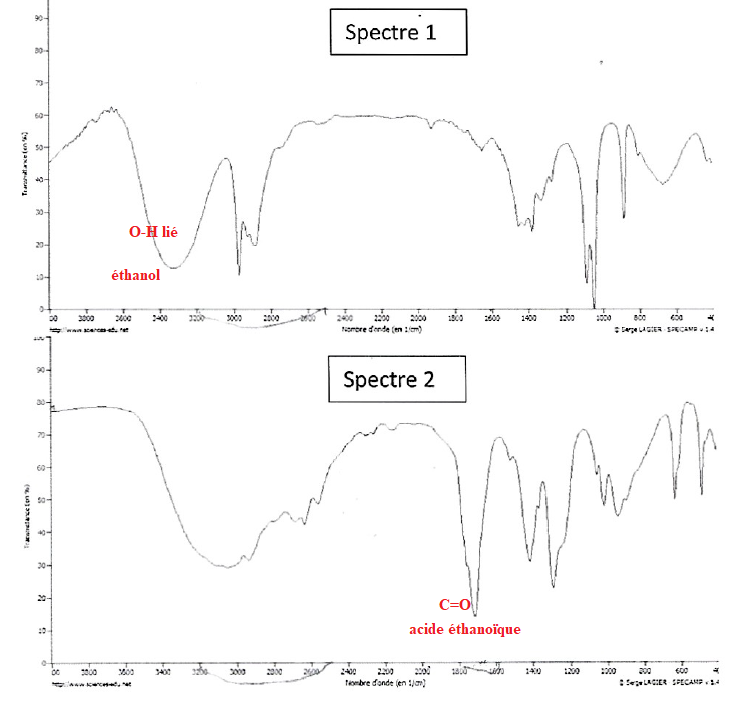 Datation au carbone 14
Datation au carbone 14.
L'activité d'un échantillon d'os humain prélevé dans une grotte
est de 0,40 ±0,05 coups par minute et par gramme. Un coup
correspond à une désintégration.
2.6 Quel est le nom
de l'appareil permettant la mesure de la radioactivité d'un échantillon
?
Compteur Geiger Muller.
2.7 Dater le
squelette humain.
 3. Dosage de l'éthanol
contenu dans une solution aqueuse notée S0
3. Dosage de l'éthanol
contenu dans une solution aqueuse notée S0.
3.1. Masse molaire
de l'éthano C
2H
6O : M = 46 g / mol. Vérifier
cette valeur.
M = 2 x12 +6 +16 = 46 g /mol.
3.2 L'étahnol est
très soluble dans l'eau. Expliquer ce fait.
L'éthanol comme l'eau sont des molécules polaires.
On prélève V
0 = 10,0 mL de la solution S
0. On
ajoute à cette échantillon de l'eau distillée jusqu'à un volume de 100
mL On obtient la solution S
1 de concentration C
1
en éthanol.
3.3 Indiquer la
verrerie nécessaire.
fiole jaugée de 100 mL ; pipette jaugée de 10,0 mL. Pissette d'eau
distillée.
3.4 Quel est le
facteur de dilution ?
100 / 10 = 10. C
1 = 0,1 C
0.
L'éthanol est transformé en acide éthanoïque par un excès de dichromate
de potassium.
Dans un erlenmeyer mélanger V
1 = 10,0 mL de solution S
1,
V
2 = 2,0 mL d'une solution de dichromate de potassium ( 2 K
+aq
+ Cr
2O
72-aq) de concentration C
2
= 0,100 mol / L et environ 10 mL d'acide sulfurique concentré. Boucher
rapidement.
Equation de cette réaction totale :
Cr2O72-aq
+ 16 H3O+aq + 3 CH3CH2OH
--> 4 Cr3+aq + 27 H2O(l) + 3 CH3COOHaq.
3.5 Pourquoi doit-on boucher
rapidement l'erlenmeyer ?
Léthanol est volatil.
3.6. Montrer que la relation entre C0
et la quantité de matière d'ion dichromate restante est :
n(éthanol) = 0,1
C0 V1.
n(dichromate ayant réagi) =2n(éthanol)
/3 = 0,1 C0 V1/
3.
n( dichromate initial )= V2C2.
n( dichromate en excès ) =V2C2
-0,1 C0 V1/
3 = V2C2 -2 C1 V1/ 3.
Dosage de l'excès de
dichromate de potassium.
On dose les ions dichromate restants avec une solution d'ion fer(II) de
concentration C3 = 0,100 mol / L. Le volume équivalent est V3
= 5,0 mL.
Cr2O72-aq
+ 14 H3O+aq +6 Fe2+aq --> 2Cr3+aq
+ 21 H2O(l) + 6 Fe3+aq.
3.7 Montrer que C1V1
= 1,5 C2V2 -0,25 C3V3.
n(dichromate en excès) = n(Fe2+) / 6 = C3V3
/ 6 = V2C2
-2 C1 V1/ 3.
C3V3
= 6V2C2
-4 C1 V1.
4 C1 V1 =6V2C2
-C3V3.
C1 V1 =1,5 C2V2 -0,25 C3V3.
3.8 Déterminer
C0.
C1 V1 =1,5 x 0,100 x2,0 -0,25 x0,100 x 5,0 =0,3 -0,125 = 0,175 mmol.
C1 = 0,175 / V1 = 0,175 / 10 = 0,0175 mol / L.
C0 = 10 C1 = 0,175 mol / L..





