Le
parkour, étude d'un indicateur coloré, bac STL Métropole 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
. |
..
..
......
...
|
Une
traceuse s’apprête à sauter du haut d’un mobilier de rue, noté bloc A,
dans le but d’atteindre le bloc B distant de 4,0 m du bloc A et plus
bas de 2,0 m. La traceuse est modélisée par un point matériel M de
masse m évoluant dans le champ de pesanteur terrestre . Dans ce modèle,
on néglige la résistance de l’air et on suppose que la traceuse n’est
soumise qu’à son poids. L’étude est menée dans le référentiel terrestre
supposé galiléen où les blocs A et B sont immobiles.
La position de la traceuse sera repérée par le point M de coordonnées
((x ; y) dans le repère représenté, la variablet, exprimée en secondes,
étant étudiée sur l’intervalle [0 ; 1].
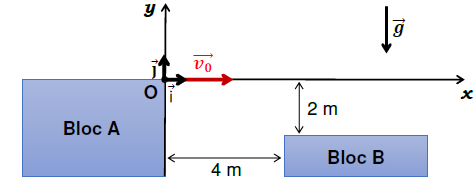
La traceuse arrive en courant à l’extrémité du bloc A. À l’instant t=
0, elle s’élance du point origine O avec un vecteur vitesse initiale v0 orienté selon l’axe horizontal (Ox) avec v0 = 7,0 m ∙ s−1. On cherche à savoir si la traceuse réussira à atteindre le bloc B.
Données :
− Masse de la traceuse m = 50 kg
− Intensité du champ de pesanteur 𝑔 = 9,8 m ∙ s−2.
1. Donner la direction et le sens du vecteur poids ainsi que l’expression littérale de sa norme.
Verticale, vers le bas, norme mg.
2. En appliquant la deuxième loi de Newton au point M, déterminer les coordonnées du vecteur accélération.
La traceuse n'étant soumise qu'à son poids, la seconde loi de newton conduit à : ax=0 ; ay = -g.
3. Déterminer les expressions du vecteur vitesse.
La vitesse est une primitive de l'accélération :
vx = cste ; vy = -gt + cste.
Vitesse initiale ( v0 ; 0) ; par suite vx = v0 ; vy = -gt.
4. Déterminer les lois horaires du mouvement de la traceuse.
La position est une primitive de la vitesse.
x(t) = v0t + cste ; y(t) = -½gt2 +cste.
La position initiale est l'origine du repère.
x(t) = v0t ; y(t) = -½gt2 .
5.
Dans l’intervalle [0 ; 1], résoudre l’équation y(t) = −2 dans laquelle
la grandeur y est exprimée en mètres. Arrondir la solution à 10−3.
2 = 4,9 t2 ; t = (2/4,9)½ ~0,639 s.
On note tc la solution de l’équation y(t) = −2.
Pour la suite de l’exercice, on prendra pour tc la valeur 0,64 s.
6. Déterminer l’abscisse de la position de la traceuse à l’instant t=0,64s.
x =7 x 0,64 =4,48 m.
7. Déterminer la valeur numérique de l’instant où l’abscisse de la position de la traceuse est égale à 4,0 m.
t = 4 / 7 =0,57 s.
8. En déduire la
valeur numérique de l’ordonnée de la position de la traceuse à
l’instant où l’abscisse de cette position est 4,0 m.
y = -0,5 x9,8 x0,572 = -1,6 m.
9. En utilisant les résultats précédents, en déduire si la traceuse atteint le bloc B.
La traceuse atteintd le bloc B à la date t = 0,64 s.
|
...
|
....
|
Étude d’un indicateur coloré
Le bleu de bromothymol est un indicateur coloré souvent utilisé lors de dosages acidobasiques.
Ses formes acide et basique constituent un couple acide base qui sera noté BBTH+/BBT. Elles présentent des teintes différentes en solution aqueuse : jaune pour BBTH+ et bleue pour BBT.
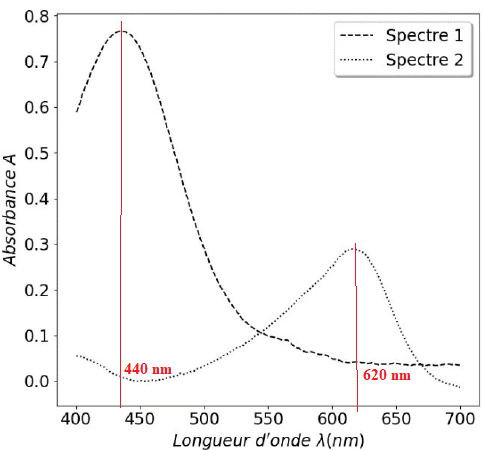
Les spectres d’absorptiont représentés
ci-après ont été obtenus par spectrophotométrie UV-visible. On désire
déterminer le spectre (1 ou 2) correspondant àchaque espèce chimique : BBTH + et BBT.
1. Déterminer, pour chacun des spectres 1 et 2, la longueur d’onde correspondant au maximum d’absorption.
.
2. Déterminer la couleur de chacune des solutions utilisées pour tracer les spectres 1 et 2.
3. Associer, en justifiant la réponse, les spectres 1 et 2 aux espèces chimiques BBTH+ et BBT.
440 nm correspond au bleu ; la couleur de la solution est la couleur complémentaire du bleu, soit le jaune BBTH+.
620 nm correspond au jaune ; la couleur de la solution est la couleur complémentaire du jaune, soit le bleu BBT.
On souhaite maintenant déterminer le pKa du couple BBTH+/BBT.
Des solutions aqueuses de bleu de bromothymol sont préparées à des pH
différents, en vue d’une étude spectrophotométrique. Les couleurs vont
du jaune (pH les plus faibles) au bleu (pH les plus élevés) en passant
par la couleur verte.
4. Écrire l’équation de la réaction modélisant la transformation chimique ayant lieu entre l’espèce chimique BBTH+ et l’eau.
BBH+aq +H2O(l) --> H3O+aq + BBHaq
5. Exprimer la constante d’acidité Ka du couple BBTH+/BBT en fonction des concentrations en quantité de matière des espèces chimiques présentes en solution.
Ka = [ H3O+aq] [BBHaq] / [BBH+aq].
6. Écrire la relation entre la constante d’acidité Ka et le pKa d’un couple acide-base.
pKa = - log (Ka).
On admet que le pKa du couple BBTH+/BBT s’exprime de la façon suivante :
pKa = pH - log([BBHaq] / [BBH+aq]) relation (1)
7. À l’aide de la relation (1), montrer que la valeur du pH d’un mélange équimolaire des espèces BBTH+ et BBT est égale au pKa du couple BBTH+/BBT.
log([BBHaq] / [BBH+aq]) = log (1) = 0 ; par suite pH = pKa.
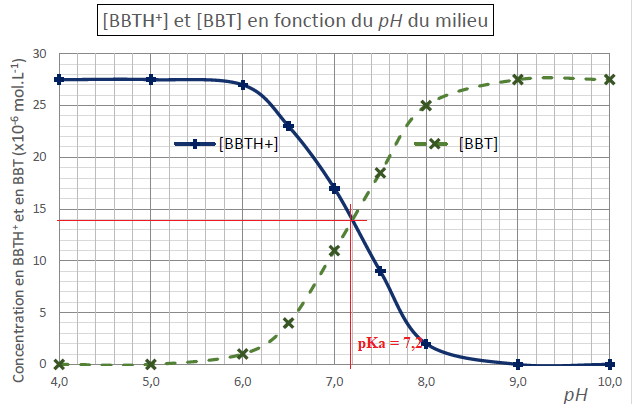
8.
En s’appuyant sur la réponse à la question 7 et sur le diagramme de
distribution déterminer la valeur du pKa du couple BBTH+/BBT. Le raisonnement sera clairement explicité et les traits de construction devront apparaitre sur le diagramme.
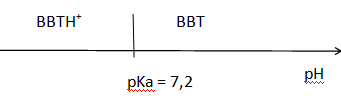
9. Tracer le diagramme de prédominance du couple BBTH+/BBT.
Un technicien prépare une solution tampon à partir des espèces chimiques BBTH+ et BBT.
10. Donner la définition d’une solution tampon.
Une solution tampon modère les variations de pH suite à une dilution
modérée et suite à l'ajout modéré d'un acide fort ou d'une base forte.
11. Déterminer, en justifiant la réponse, la couleur de la solution tampon préparée par le technicien.
[BBHaq] ~ [BBH+aq]; pH ~pKa ; la solution est de couleur verte.
|
|
|
|