Fabrication
de savons artisanaux, bac SPCL Métropole 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
. |
..
..
......
...
|
PARTIE A - Étude de la transformation de saponification
Sous l’action d’une solution aqueuse d’hydroxyde de sodium concentrée,
appelée « lessive de soude », les triesters contenus dans l’huile
végétale se fragmentent : il se forme des ions carboxylate (qui
permettront l’obtention du savon) et du glycérol.
Cette transformation s’appelle une saponification.
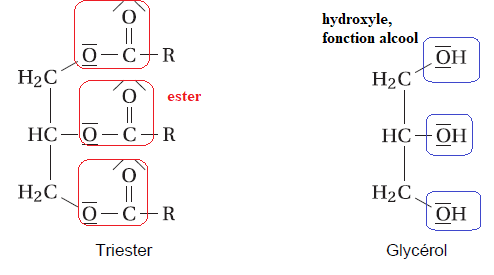
A.1.
Entourer les groupes caractéristiques des molécules de triester et de
glycérol et nommer les fonctions chimiques correspondantes.
Le mécanisme réactionnel de la saponification est donné.
A.2.
Identifier le nom du type de réaction (addition, substitution,
élimination, acide/base) correspondant à l’étape n°1 du mécanisme
réactionnel.
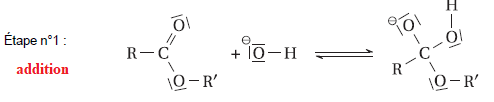
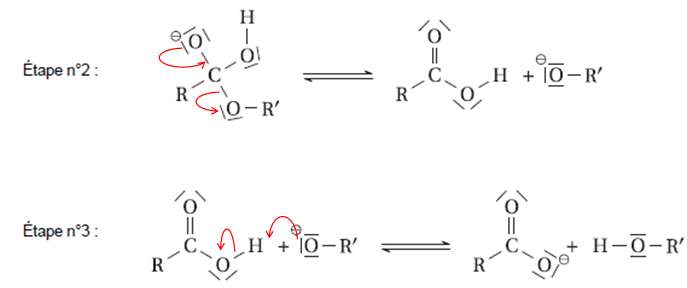
A.3.
Compléter les étapes n°1 et n°2 du mécanisme réactionnel en ajoutant
les flèches courbes modélisant le déplacement des doublets d’électrons.
On réalise une saponification avec une masse m= 100,0 g du triester et un excès d’hydroxyde de sodium en solution aqueuse.
Données :
– masse molaire du triester : M1 = 884 g / mol ;
– masse molaire du savon : M = 304 g / mol.
A.4. Calculer la valeur de la quantité de matière n du triester introduit dans le mélange réactionnel.
n =m / M1 = 100 / 884 =0,113 mol.
On suppose que la transformation chimique de saponification est totale.
A.5. En déduire que la quantité de matière maximale de savon formé vaut n2 = 0,339 mol.
3 n1 = 3 x0,113 =0,339 mol.
A.6. À la fin de la transformation, on obtient une masse m = 76,4 g de savon. Calculer la valeur du rendement de la synthèse.
Masse théorique de savon : 0,339 x 304 ~103 g.
Rendement = masse réelle /masse théorique = 76,4 / 103 =0,74 (74 %).
PARTIE B - Contrôle qualité des réactifs de la transformation de saponification
La « lessive de soude » est une solution aqueuse très concentrée d’hydroxyde de sodium (Na+ aq + HO-aq) préparée à partir d’un solide blanc d’hydroxyde de sodium.
Préparation de la solution aqueuse de « lessive de soude »
B.1. Nommer les équipements de protection individuelle nécessaires pour manipuler une « lessive de soude » en toute sécurité.
La solution étant corrosive, port de blouse, gants et lunette.
B.2. L’équation qui modélise la dissolution de l’hydroxyde de sodium dans l’eau est :
NaOH(s) ⇄ Na+ aq + HO-aq
Donner l’expression du produit de solubilité Ks associé à cette équation de dissolution.
Ks =[ Na+ aq] [ HO-aq]
B.3. Sachant que le produit de solubilité de l’hydroxyde de sodium NaOH(s) est Ks = 742,6 à 20 °C,
exprimer sa solubilité s en fonction de Ks puis calculer sa valeur.
Ks = s2 = 742,6 ; s =27,3 mol / L.
Contrôle qualité de la solution
On dispose d’une solution aqueuse d’hydroxyde de sodium « lessive de soude » S0 dont on souhaite vérifier la concentration en quantité de matière d’hydroxyde de sodium C0. On dilue 25 fois la solution S0 pour obtenir la solution S que l’on dose par titrage.
B.4. On souhaite préparer un volume de 500,0 mL de la solution S. La verrerie à disposition est la
suivante :
– pipettes jaugées de 5,0 mL, 10,0 mL et 20,0 mL ;
– fioles jaugées de 100,0 mL, 200,0 mL et 500,0 mL.
Choisir, en justifiant, les deux instruments de verrerie permettant de préparer la solution S.
Fiole jaugée de 500,0 mL et pipette jaugée de 500 / 25 =20,0 mL.
On réalise un titrage conductimétrique d’un volume VB = 20,0 mL de solution S par une solution aqueuse d’acide chlorhydrique SA de concentration en quantité de matière CA = 0,500 mol / L. La courbe de suivi conductimétrique est représentée.
L’équation de la réaction support du titrage est :
H3O+(aq) + HO-(aq) ⟶ 2 H2O (ℓ)
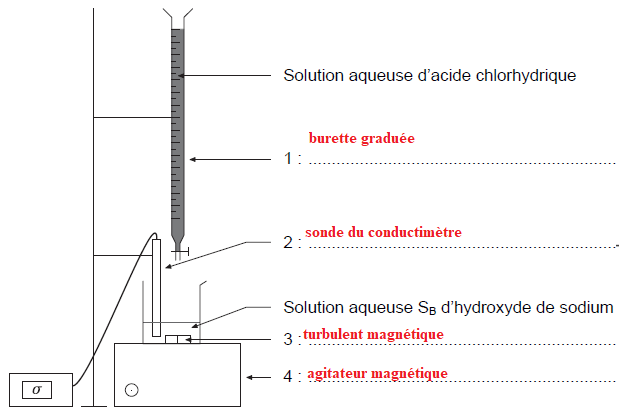
B.5. Compléter les légendes numérotées de 1 à 4 sur le schéma du dispositif de titrage conductimétrique.
B.6. Définir l’équivalence d’un titrage.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
B.7. Interpréter le changement de pente observé sur la courbe de suivi conductimétrique.
Avant l'équivalence HO- est en défaut : tout ce passe comme si on remplaçait l'ion H3O+(aq) par l'ion Na+aq de conductivité molaire ionique moindre. La conductivité de la solution diminue.
Après l'équivalence HO- est en excès et on ajoute des ions Na+aq : la conductivité de la solution croît.
B.8. Déterminer la valeur VE du volume versé à l’équivalence du titrage.
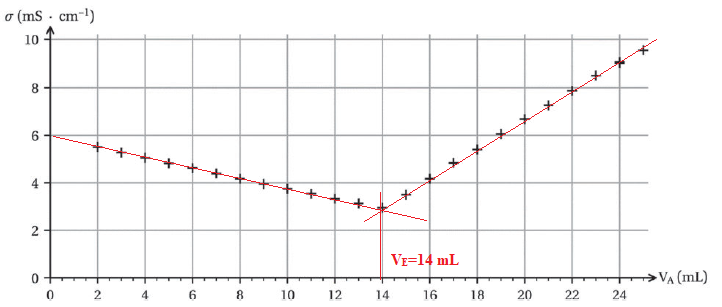
B.9. Déterminer la valeur de la concentration en quantité de matière d’hydroxyde de sodium de la solution S0.
CA VE = CB VB ; CB =0,500 x 14,0 / 20,0 =0,35 mol / L.
Tenir compte de la dilution : 0,35 x 25 =8,75 mol / L.
Ce titrage a été réalisé 9 fois. Les 9 mesures ont donné les résultats suivants :
- valeur moyenne de la concentration : C = 8,73 mol / L ;
- valeur de l’écart-type expérimental : 0,094 mol / L.
B.10. Déterminer la
valeur de l’incertitude-type u(C) sur la concentration en quantité de
matière d’hydroxyde de sodium C de la solution S0.
u(C) = écart type / racine carré du nombre de mesures = 0,094 / 3 =0,031 mol / L.
B.11. En déduire si
la valeur de C est compatible avec la valeur de référence, qui vaut
8,75 mol/ L. Conclure sur la qualité de la « lessive de soude ».
Ecart normalisé = (8,75 - 8,73) / 0,031 =0,65, valeur inférieure à 2.
Le résultat de la mesure et la valeur de référence sont compatibles.
|
...
|
....
|
PARTIE C - Préparation de la pâte à savon et moulage
On s’intéresse à une installation industrielle de fabrication du savon.
La transformation de saponification entre les huiles et la « lessive de
soude » est effectuée dans un réacteur, dans lequel une sonotrode
génère des ondes ultrasonores.
Contrôle de la température des réactifs.
La lessive de soude (90°C) et l’huile (0°C) ont des températures
initiales très différentes. Deux échangeurs thermiques permettent de
diminuer cet écart avant introduction dans le réacteur. Un circuit
d’eau unique permet de refroidir la « lessive de soude » dans
l’échangeur E1 puis de réchauffer l’huile dans l’échangeur E2. La caractéristique de l’échangeur E2 est donnée.
C.1. Indiquer si l’échangeur thermique E2 fonctionne à co-courant ou à contre-courant, en justifiant la réponse.
Co-courant : les deux fluides sont disposées parallèlement et vont dans le même sens.
La puissance transférée dans l’échangeur E1 vaut P1 = 28 kW. On note P2 la puissance transférée dans l’échangeur E2. Pour envisager un circuit d’eau unique, il faut que P1 < P2.
C.2. Calculer la valeur de la puissance P2 et conclure.
P2 = U S Dq :
U = 1200 W m-2 ; S = 1,0 m2 ; Dq= 19°C.
P2 =1200 x19 =22 800 W = 22,8 kW > P1.
On ne peut pas envisager un circuit d'eau unique.
Transformation chimique au sein du réacteur.
La sonotrode génère des ondes ultrasonores qui se propagent dans le
milieu réactionnel. Le phénomène de cavitation acoustique se produit :
il y a formation, croissance et implosion de bulles de gaz dans le
milieu. La brusque implosion de ces bulles de gaz de quelques
micromètres de
diamètre est accompagnée d’effets locaux très intenses, notamment l’augmentation de la température.
C.3. Déterminer l’intérêt de la cavitation acoustique sur la cinétique de la réaction de saponification.
Augmentation de la cinétique de la réaction.
C.4. Justifier que la sonotrode émet bien des ondes ultrasonores, ce qui permettra le phénomène de cavitation.
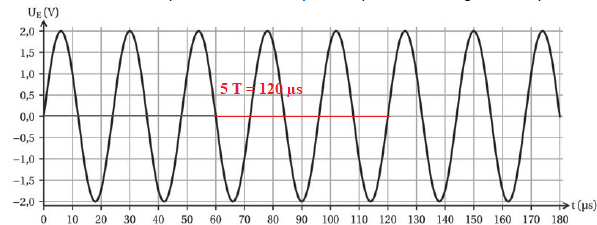
T = 120 / 5 =24 µs ; fréquence f = 1 / T = 1 /(24 10-6)=41 666 Hz, valeur supérieure à 20 000 Hz.
41 666 Hz appartient au domaine des ultrasons.
Moulage de la pâte à savon
Une fois la transformation de saponification terminée, la pâte de savon est déversée dans un moule
de volume V = 0,040 m3.
C.5. Montrer qu’un débit volumique Q = 1,3×10-4 m3 ∙ s-1 est nécessaire pour remplir le moule en 5,0 minutes.
5 min = 5 x60 = 300 s.
Débit = volume / durée =0,040 / 300 =1,3×10-4 m3 ∙ s-1 .
On rappelle que l’aire d’une section circulaire d’un tuyau de diamètre D a pour expression S =3,14 D2 / 4.
C.6. En déduire la
valeur du diamètre D de la section circulaire que doit avoir la
canalisation de vidage du réacteur pour que la vitesse d’écoulement v
soit égale à 0,20 m / s.
Section = débit / vitesse = 1,3 10-4 / 0,20 =6,67 10-4 m2.
6,67 10-4 =3,14 D2 / 4.
D2 =6,67 10-4 x4 / 3,14 =8,5 10-4 ; D = 0,029 m.
PARTIE D - Contrôle du remplissage du moule
On s’intéresse à deux procédés de contrôle du remplissage du moule : un
détecteur de niveau à lames vibrantes et un capteur de masse contrôlé
par un microcontrôleur.
Pour utiliser un détecteur de niveau à lames vibrantes, il faut déterminer au préalable la fréquence de résonance des lames.
On étudie en laboratoire les vibrations d’une lame métallique en régime
d’oscillations forcées afin de déterminer sa fréquence de résonance. Le
dispositif permet de mesurer une tension électrique qui traduit
l’amplitude des oscillations de la lame, représentée ci-dessous.
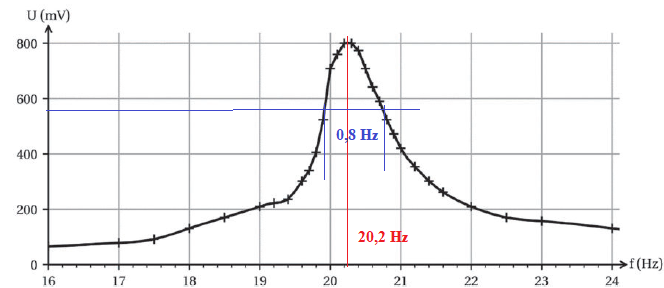
D.1. Déterminer la valeur de la fréquence de résonance de la lame étudiée.
f =20,2 Hz.
Le facteur de qualité est un nombre sans dimension qui caractérise la résonance d’un oscillateur.
Il est défini par : Q =f / Df.
Df= 0,8 Hz, intervalle de fréquences entre lesquelles l’amplitude est supérieure à Amax / 2½.
D.2. Déterminer la valeur du facteur de qualité Q de la résonance de la lame étudiée.
Q = 20,2 / 0,8 ~ 32.
Lorsque la lame vibrante est en contact avec le fluide, ses oscilletions sont amorties.
D3. Comment cet amortissement est-il observé ?
Diminution de l'amplitude des oscillations jusqu'à s'annuler..
D.4. Préciser comment évolue la valeur du facteur de qualité Q lors du contact de la lame avec le
fluide.
Q tend vers zéro.
D.5. Calculer la valeur du quantum q du CAN utilisé dans le capteur.
DU plage de conversion -40 mV ; +40 mV.
Résolution N = 24 bits.
q = DU / (2N-1) =80 /(224-1)=5 10-6.
D.6. Indiquer quelle ligne du programme permet d’allumer la DEL.
Ligne 13.
D.7. Réécrire la ligne 12 du programme en la complétant pour que la DEL s’allume à partir d’une masse d’une valeur de 200 g.
if (masse >= 200).
|
|
|
|