Prévention
et suivi d'un cancer colorectal,
bac ST2S 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
. |
..
..
......
...
|
Exercice 1 : Exposition aux nitrites et risque de cancer colorectal (10 points)
Partie A : Les nitrites dans la charcuterie, facteur de risque du cancer colorectal.
L’Organisation
Mondiale de la Santé (OMS), dans un rapport paru en 2015, indique que
la consommation journalière de plus de 50 g de charcuterie augmente le
risque d’avoir un cancer colorectal.
1. Définir la dose journalière admissible (DJA).
Quantité estimée d'une substance présente dans les aliments ou dans l'eau potable qui peut être consommée en une journée.
2. Calculer la masse maximale d’ions nitrite que peut contenir 50 g de charcuterie française.
Maximum 120 mg de nitrite par kg de charcuterie.
120 x 50 / 1000 = 6 mg dans 50 g de charcuterie.
3. Montrer que la consommation journalière de 50 g de charcuterie française présente un risque pour un adulte de 70 kg.
Donnée : Dose journalière admissible d’ions nitrite : DJA = 0,07 mg∙kg-1.
6 mg d'ion nitrite dans 50 g de charcuterie.
6 /70=0,086 mg kg-1, valeur supérieure à la DJA..
Partie B : Dosage des ions nitrite dans une eau
La teneur en ions nitrite dans l'eau destinée à la consommation humaine
est, elle aussi, strictement règlementée et ne doit pas dépasser 0,10
milligramme par litre d’eau après traitement. Pour contrôler la
conformité d’une eau, on opte pour le dosage par étalonnage
spectrophotométrique des ions nitrite.
On dispose d’une gamme de solutions aqueuses dont la concentration en masse Cm
des ions nitrite est connue. Les solutions aqueuses contenant des ions
nitrite sont incolores. L’ajout d’un réactif de diazotation en excès
conduit à la formation d’un produit rose. Pour une longueur d’onde
appropriée, on mesure l’absorbance A de chaque solution, ce qui conduit
à la courbe d’étalonnage représentée.
4. Préciser un critère à prendre en compte pour choisir la longueur d’onde à laquelle l’absorbance est mesurée.
Pour une meilleure précision, on se place à la longueur d'onde correspondant au maximum d'absorption.
On prélève l’eau d’une nappe phréatique à laquelle on ajoute le réactif
de diazotation selon le même protocole que pour les solutions ayant
servi à l’étalonnage. L’absorbance de l’eau de la nappe phréatique à la
longueur d’onde choisie vaut : A = 0,2.
5. Justifier le caractère potable ou non potable de cette eau.
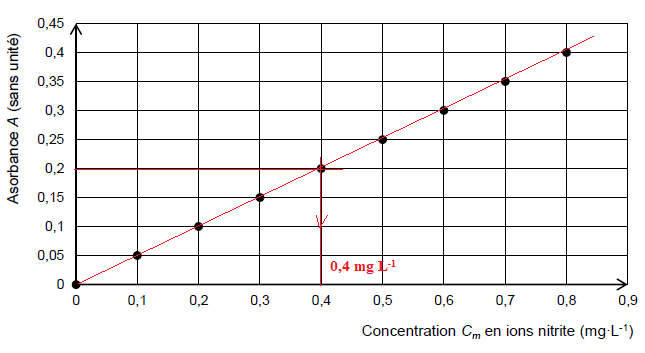
0,4 est supérieur à 0,1 mg / L : l'eau est non potable.
Si la teneur en ion nitrite dans l'eau potable est réglementée, celle
des ions nitrate l’est également en raison de leur capacité à se
transformer en ions nitrite. Ainsi, pour tenir compte des deux sources
possibles de pollution, les concentrations en ions nitrate et nitrite
dans l’eau peuvent être exprimées sous forme de concentration en masse
en élément azote.
6. Déterminer la concentration en quantité de matière d’une solution d’ions nitrate NO3− de concentration en masse 1,0 mg L-1.
M(NO3−) =14 +3 x16=62 g / mol ;
1,0 10-3 / 62 =1,6 10-5 mol / L.
7. En déduire que la concentration en masse en élément azote est égale à 0,226 mg / L en élément azote.
1,6 10-5 x M(azote) =1,6 10-5 x14 =2,26 10-4 g / L =0,226 mg / L.
Données : Masses molaires atomiques M(N) = 14,0 g·mol ˗1 ; M(O) = 16,0 g·mol˗1.
8. Indiquer sans calcul si une concentration en masse d’un milligramme par litre (1,0 mg / L) en ions nitrite NO2−
est équivalente à une concentration en masse en élément azote
inférieure, supérieure ou égale à 0,226 mg / L. Justifier
qualitativement la réponse.
M(azote) / M(nitrite) =0,226 x14 /(14+32) =0,304 mg / L en élément azote.
|
...
|
....
|
Exercice 2 : L’imagerie médicale au service des cancers digestifs (10 points)
La tomographie par émissions de positons (TEP) est l’examen d’imagerie
fonctionnelle le plus utilisé dans la prise en charge des patients
atteints d’un cancer digestif.
1. Donner la composition du noyau des atomes de fluor 18, noté 189F, et celle du noyau d’un atome de fluor 19, noté 199F.
189F : 9 protons et 18-9 = 9 neutrons.
199F : 9 protons et 19-9 = 10 neutrons.
2. Justifier que le fluor 18 et le fluor 19 sont des isotopes d’un même élément.
Ces deux atomes ne diffèrent que par leur nombre de neutrons.
La désintégration du fluor 18 peut être modélisée de façon simplifiée par l’équation de réaction :
189F -- >188O* +01e.
Le noyau 188O* se désexcite en 188O en émettant un rayonnement électromagnétique.
3. Préciser les
natures des émissions radioactives respectivement associées à la
désintégration du fluor 18 et à la désexcitation de l’oxygène 18.
Désintégration du fluor 18 : 01e positon radioactivité de type ß+.
Désexcitation de l’oxygène 18 : émission d'un rayonnement gamma ou X.
4. Proposer une définition de la demi-vie radioactive d’un radioélément (également appelée période radioactive).
Durée au bout de laquelle l'activité initiale est divisée par 2.
5. Déterminer la demi-vie (ou période) radioactive du fluor 18.
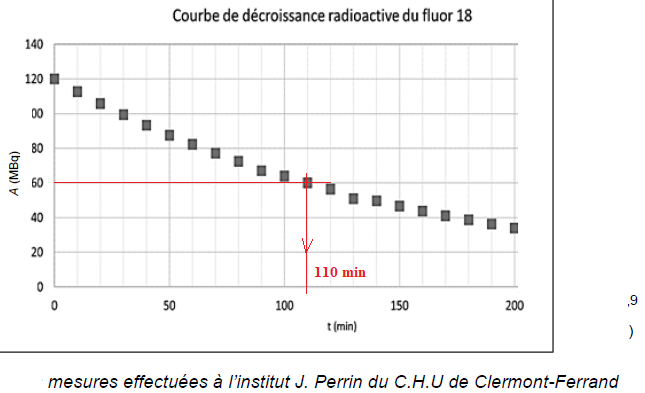
6. Déterminer le temps au bout duquel la quantité initiale de 189F est divisée par 128. On notera que 128 = 27.
Au bout de 7 périodes soit 7 x110 =770 min ou 12 h 50 min.
7. Expliquer
pourquoi le produit radiopharmaceutique marqué au fluor 18 doit être
utilisé dans les heures qui suivent le moment de sa fabrication.
Sa période radioactive est relativement courte 110 min ( 1 h 50 min).
Il doit être utilisé dans les heures sui suivent sa fabrication.
.
|
|
|
|