Cycle
d'un gaz parfait,
Concours ENAC 2024.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Un gaz, supposé parfait (n moles), suit le cycle de transformations réversibles (E1, E2, E3, E4) suivantes
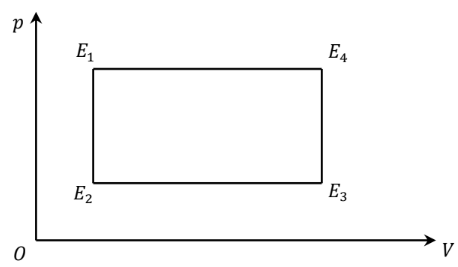
On désigne par pk, Vk et Tk les pressions, volumes et températures des états Ek, où k = 1, 2, 3 ou 4. On note R la constante des gaz parfaits et g = Cpm ⁄ Cvm,
le rapport de la capacité thermique molaire à pression constante sur la
capacité thermique molaire à volume constant. On note respectivement Wij et Qij le travail et la chaleur (transfert thermique) algébriquement reçu par le gaz lors de la transformation menant de l’état Ei à l’état Ej. On désigne par W le travail algébriquement reçu par le gaz sur le cycle. Les températures T1 et T3 sont égales. On pose k = p1/ p3.
.
1. Exprimer T2 et T4 en fonctions de k et T1.
p2V2=nRT2 ; p1V1=nRT1 ; V1=V2 ; p2=p3.
p3V1=nRT2 ; p1 / p3=T1/T2 = k ; T2 = T1 / k.
p4V4=nRT4 ; p3V3=nRT3 ; V3=V4 ; p4=p1.
p1V3=nRT4 ; p1 / p3=T4/T3 = T4/T1 = k ; T4 = T1 k.
2. Exprimer W12 et Q12 .
W12 = 0 car le volume reste constant.
Premier principe : W12 +Q12 .=n Cvm(T2-T1).
Q12 =n Cvm(T1 /k-T1)= n Cvm T1 (1 / k-1) =n Cvm T1 (1-k) / k.
3. Exprimer W23.
W23 =p2(V2-V3)=p3(V2-V3)= p3 V2-nRT3= p2 V2-nRT3 =nR(T2-T3) = nR(T2-T1) = nR(T1/k-T1) =nRT1 (1-k) / k.
4. Exprimer Q23 .
La transformation 2 --> 3 est isobare : Q23 = DH23 = nCpm(T3-T2) =nCpm(T1-T2) =nCpm(T1-T1/k) =nCpm T1(1-1/k).
Q23 =nCpm T1(k-1)/ k.
Or g = Cpm ⁄ Cvm ;
Relation de Mayer : Cpm-Cvm =R ; Cpm-Cpm / g=R ; Cpm(1-1/ g) = R ; Cpm(g-1) / g = R ; Cpm= R g /(g-1).
Q23 =nR g /(g-1)T1(k-1)/ k.
|
...
|
....
|
5. Que vaut W ?
W = W12+W23+W34+W41=0 +nRT1 (1-k) / k +0 -p1(V1-V4).
-p1(V1-V4) =-nRT1 +p1V4 =-nRT1 +p4V4 =-nRT1 +nRT4 =-nRT1 +nRT1 k=nRT1 (k-1).
W = nRT1 (1-k) / k +nRT1 (k-1)=nRT1 (k-1) (1-1/k)=nRT1 (k-1)2/k.
6. Quels sont les signes de Q34 et de Q41 ?
A volume constant, une augmentation de pression se traduit par une
augmentation de température ; donc une augmentation de l'énergie
interne.
W34 =0, isochore ; Q34 >0.
A pression constante, une diminution de volume signifie une
diminution de température, donc une diminution de l'enthalpie ; c'est à
dire une libération de chaleur : Q41 < 0.
|
ane.
|
|
|