Le
lactate d’éthyle est un composé de formule semi-développée
H
3C-CH(OH)-COOCH
2CH
3 que l’on retrouve
dans différents secteurs industriels, notamment utilisé comme solvant,
décapant, additif alimentaire ; on le
retrouve aussi dans la formulation de produits cosmétiques ou encore la
synthèse de médicaments.
Données :
Masse molaire du lactate d’éthyle : 118,0 g.mol
-1 ;
Masse molaire de l’acide lactique : 90,0 g.mol
-1 ;
Masse molaire de l’éthanol : 46,0 g.mol
-1
II-1- Donner la formule brute du lactate d’éthyle.
C
5H
10 O
3.
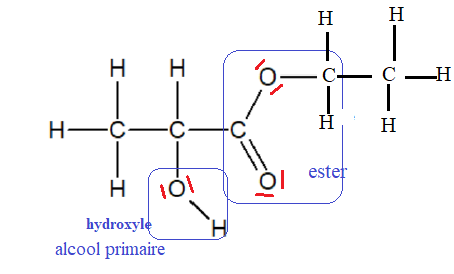
II-2- Représenter le schéma de Lewis du lactate d’éthyle. Entourer les
groupements fonctionnels
présents dans la molécule et nommer les fonctions correspondantes.
La synthèse du lactate d’éthyle peut être obtenue par réaction de
l’acide lactique H
3C-CH(OH)-COOH sur
l’éthanol H
3C-CH
2OH, selon l’équation-bilan :
H
3C-CH(OH)-COOH + H
3C-CH
2OH = H
3C-CH(OH)-COOCH
2CH
3 + X.
On réalise pour la mettre en œuvre un mélange équimolaire 10,0 mol
d’acide lactique + 10,0 mol d’éthanol,
auquel on ajoute quelques gouttes d’acide sulfurique. On considéra le
volume constant.
II-3- Donner les valeurs des masses d’acide lactique et d’éthanol qu’il
faut introduire dans le réacteur
pour obtenir le mélange initial désiré.
acide lactique : 10,0 x 90,0 = 900 g ; éthanol : 10,0 x 46,0 =460 g.
II-4- Identifier le composé X qui se forme au cours de la synthèse.
X est l'eau H
2O.
II-5- Préciser le rôle de l’acide sulfurique.
Catalyseur.
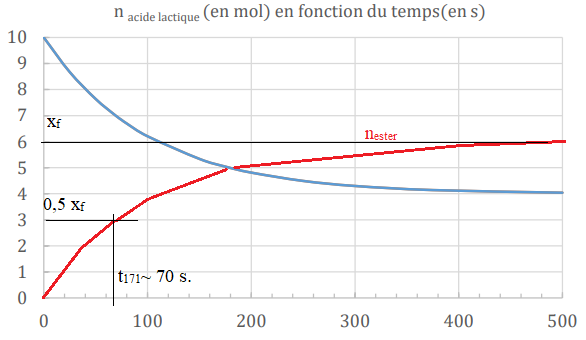
La quantité d’acide lactique en fonction du temps est suivie
expérimentalement et donne les mesures
suivantes :
II-6- Représenter sur le même graphe l’évolution de la quantité de lactate d’éthyle formé au cours du
temps.
II-7- Déterminer le temps de demi-réaction t
½.