Chimie
analytique, la cocaïne, QCM.
Concours technicien police technique et scientifique 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
|
.
.
|
|
..
.
|
..
..
......
...
|
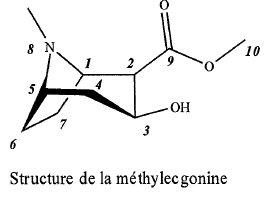
1. Calculer la masse molaire.
C10H17NO3. M = 10*12 +17 +14+3*16 =199 g / mol.
2. Identifier les atomes de carbone asymétriques.
Carbone n° 2, 3.
3.
La masse molaire de la cocaîne base est de 303,4 g/mol alors que la
forme chlorhydrate est de 339,8 g/mol. Expliquer cette différence.
Protonation de la fonction amine par l'acide chlorhydrique.
4. Proposer une formule brute et une formule développée de la cocaïne base.
C 17H 21NO 4.
5. Identifier le réactif limitant et calculer le rendement.
C10H17NO3 + C6H5COCl --> C17H21NO4 + HCl.
n(C10H17NO3) =3,62 / 199=0,018 mol.
n(C6H5COCl)=3,05 / 140,5~0,022 mol ( en excès).
n( C17H21NO4) théorique = 0,018 mol.
Masse théorique : 0,018 x303,4 =5,5 g.
Masse expérimentale : 1,57 g.
Rendement : 1,57 / 5,5 ~0,29 ( 29 %).
6. Pourquoi utiliser un solvant, benzène sec ?
En présence d'eau, on peut avoir l'hydrolyse partielle de l'ester.
7. Compléter le tableau.
Solvant
|
Chlorhydrate de cocaîne
|
cocaîne
|
eau( acide)
|
très soluble
|
insoluble
|
eau (base)
|
|
|
benzène
|
insoluble
|
|
éther diéthylique
|
|
très soluble
|
n-hexane
|
insoluble
|
|
8. Quel est le nom du solvant CHCl3 ? Est-ce un solvant plus ou moins polaire que l'acétate d'éthyle ?
Le trichlorométhane ou chloroforme est moins polaire que l'acétate d'éthyle.
9. Comment sécher une phase organique ?
On utilise un sel possédant une forte affinité pour l'eau ( sulfate de
magnésium ou de sodium). On met assez de sel pour que le solide reste
sous forme de légère suspension à l'agitation.
10. Un pic à m/z= 77 Th apparaît. Donner la formule brute et développée de cet ion. Comment s'appelle le pic à m /z = 303Th ?
m/z = 77 TH, cation phényl C6H5+.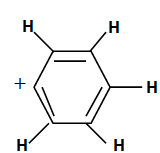
m/z = 303 Th, pic moléculaire.
11. Quelle est l'unité du coefficient d'extinction molaire ?
e = A / (CL) ; C en mol m-3 ; L en m ; e en mol-1 m2.
12. Test d'identification de la cocaîne dans un échantillon.
Dissoudre 1 g de soude dans 20 mL de méthanol. Humidifier
l'échantillon, séché avec le réactif formé. Laisse l'excès d'alcool
s'évaporer et comparer l'odeur caractéristique du résidu à celle d'un
étalon de cocaîne ( odeur de goyage).
Seule la piperocaîne donne dans les mêmes conditions la même odeur.
Expliquer la réaction en identifiant la molécule qui donne cette odeur caractéristique de goyave.
Le benzoate de méthyle C6H5COOCH3 possède une odeur de goyave.
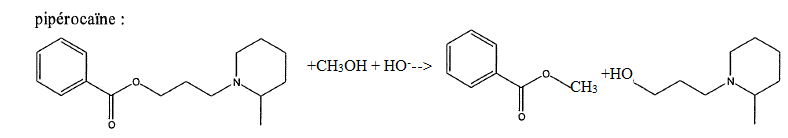 13.a.
13.a. Quel est le degré d'oxydation du cobalt utilisé lors du test de Scott ?
Co(SCN) 2 : le degré d'oxydation du cobalt est +2.
13.b. Quelle est la concentration molaire de l'acide chlorhydrique utilisé ? 37 %, d = 1,19.
Masse de 1 L : 1190 g.
Masse d'acide chlorhydrique : 1190 x0,37 =440,3 g. Mase molaire HCl : 36,5 g / mol.
Concentration : 440,3 / 36,5 =12 mol / L.
13.c. Qu'appelle t-on un faux positif ?
Un test de dépistage donne un résultat positif mais un test de
confirmation infirme cette information par un résultat négatif ou
indéterminé. La lidocaîne donne un faux positif dans le test de Scott.
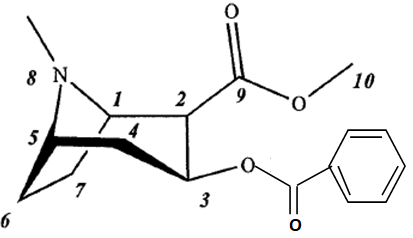
14. Dessiner la molécule de benzoylecgonine.
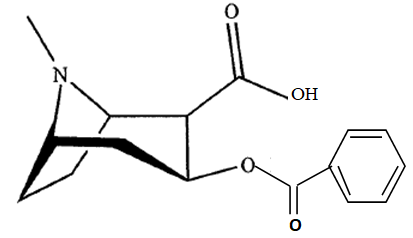 Partie 2. Analyse chromatograaphique d'un échantillon de cocaîne
Partie 2. Analyse chromatograaphique d'un échantillon de cocaîne.
1. Que signifie CPG/FID ?
Chromatographie en phase gazeuse, détecteur à ionisation de flamme.
2. A quoi correspondent les différentes dimensions de la colonne ? (30 m x0,25 mm x 0,25 µm).
Longueur 30 m ; diamètre 0,25 mm ; épaisseur de la phase stationnaire 0,25 µm.
3. Que signifie radio de split 50:1 ?
1/50 du volume injecté dans la chambre de vaporisation est envoyé dans la colonne.
4. Le fonctionnement du détecteur FID nécessite des gaz. lesquels ?
Comment vérifier que ce détecteur est en mode "On" ?
Hélium, argon, azote hydrogène.
5. Quel autre type de gaz vecteur peut être utilisé en CPG/FID ? Quelles doivent être ses spécificités ?
Le
gaz vecteur doit être pur, inerte (il ne doit pas réagir avec les
constituants de l'échantillon à séparer) et non miscible avec la phase
stationnaire.
6. Quel est le mode de fonctionnement du four colonne ? Quel est son intérêt ?
Le four est de type chaleur tournante dont la température est précisément ajustable.
7. Quels sont les critères essentiels pour choisir un étalon interne ?
L'étalon interne n'est pas
facile à trouver : il doit avoir une structure chimique proche des
solutés analysés, ne pas interférer avec les solutés, ne pas réagir
chimiquement avec d'autres constituants présents et doit être
compatible avec le système de détection.
8. La méthode de
O.Guéniat inclut lors de la phase de préparation de l'échantillon, une
dérivatisation au MSTFA. Quel est l'intérêt de cett étape ?
La dérivatisation permet d'analyser des composés très difficile à volatiliser.
9. Un technicien
analyse un échantillon avec les conditions analytiques de la méthode
d'O. Guéniat avec une colonne de longueur 15 m. Quelle(s)
conséquence(s) cela va-t-il avoir sur le chromatogramme ?
Diminution du nombre de plateaux théoriques, donc moindre éfficacité.
10. Rappeler en 3 lignes le principe de l'HPLC.
L'échantillon
à analyser est entraîné par la phase liquide mobile dans une
colonne remplie d'une phase stationnaire constituée de grains de petite
taille. Un débit élevé de la phase mobile et cette fine granulométrie
permet une bonne séparation des composants.
11. La colonne greffée C18 est-elle polaire ou apolaire ?
Cette phase est apolaire.
12. Que représentent les valeurs indiquées sur la colonne : 4,6 x 100 mm, 5 µm ?
4,6 mm : diamètre intérieur de la colonne ; 100 mm : longueur de la colonne ; 5 µm : taille des particules.
13. Un des solvants utilisé est de l'eau ultrapure acidifiée par de l'acide formique.
a. Ecrire les différents équilibres qui s'établissent dans cette solution.
2H2O = HO- + H3O+.
HCOOH + H2O = HCOO- +H3O+.
b. A partir du pH = 2,7 de la solution, calculer la concentration molaire en acide formique ( pKa = 3,8).
pH =pKa + log([HCOO- ] / [HCOOH]).
log([HCOO- ] / [HCOOH]) = 2,7-3,8 = -1,1 ; [HCOO- ] / [HCOOH ]= 10-1,1 ~0,08.
c. Quel type d'électrodes faut t-il utiliser pour mesurer le pH de la solution ?
Une électrode de verre ainsi qu’une électrode de référence.
d. Comment préparer une solution tampon ?
Mélanger un acide faible ( ou une base faible) avec un sel de sa base conjuguée ( ou de son acide conjugué).
Prendre une solution d'acide faible dont on neutralise la moitié à
l'aide d'une bas forte ( titrage acide base avec arrêt à la demi-
équivalence).
14. Calculer le facteur de capacité K' pour la cocaïne. Que représente-t-il ?
K' = (tr i-tm ) / tm =(7,9-2) / 2,0 =2,95.
K' permet d'appréhender la capacité de la colonne à retenir un composé dans des conditions d'élution données..
15. De quels facteurs dépend le facteur de capacité ?
Du débit, de la température d'élution, de la composition de la phase mobile.
16. A partir des données du pic n°4 ( tr = 7,9 ; d = 0,186 ) , calculer le nombre de plateaux théorique de la colonne.
N = 16 ( tri / Ii)2= 16 ( 7,9 / 0,186)2 =2,89 104.
tri : temps de rétention du pic i ; Ii largeur à la base du pîc.
17. Comment évolue la HEPT en fonction du débit ?
L'efficacité diminue avec l'augmentation du débit.
18. Calculer le facteur de résolution Rs entre les pics 3 et 4. Sont-ils bien résolus ?
Rs = 2( tr2-tr1) / ( d1+d2)=2(7,9-6,7) /(0,186+0,158)~ 7, valeur supérieure à 1,5, les pics sont correctement séparés.
19. Citer trois autres types de détecteurs utilisés en HPLC.
Détecteurs UV, visible, de fluorescence, de spectrométrie de masse.
|
...
|
....
|
QCM.
1. Dans la loi de Beer Lambert, le coefficient d'extinction molaire dépend de l'espèce chimique et de la longueur d'onde.
2. Quel est le nom de ce composé ?
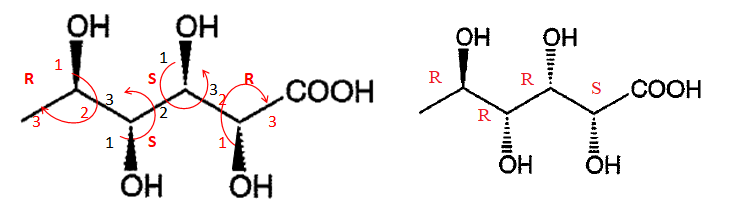
acide (2S,3R,4R,5R)-2,3,4,5-tétrahydroxyhexanoïque.
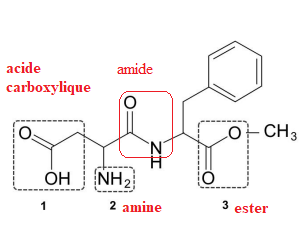
3. L'aspartame comporte une fonction :
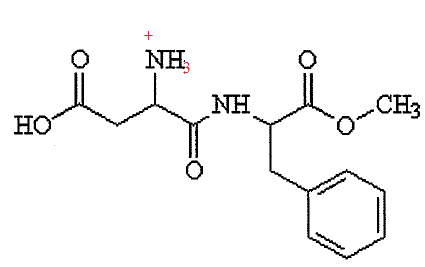
4. L'aspartame possède deux valeurs de pKa : 3,1 et 7,9. Sur quelle fonction est rataché le proton correspondant à un pKa de 3,1 ?
5. A quel composé n'appartient aucun des spectres suivants :
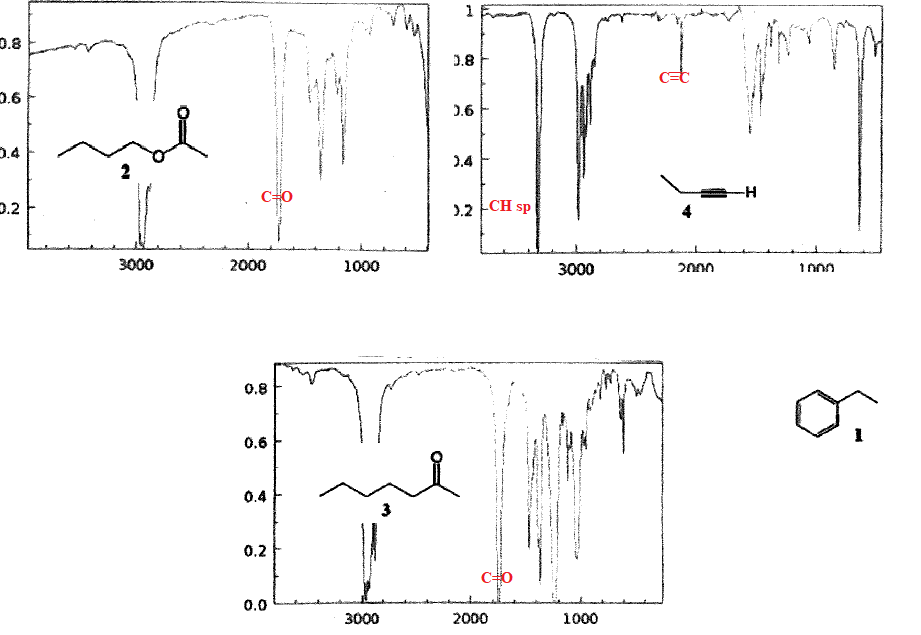
|
|