Chimie
analytique: scopolamine, le PETN, concours technicien de la police
technique et scientifique
2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Dosage de la scopolamine par HPLC dans les cheveux.
1. Rappeler la composition d'une solution tampon.
Mélanger un acide faible ( ou une base faible) avec un sel de sa base conjuguée ( ou de son acide conjugué).
Prendre une solution d' acide faible dont on neutralyse la moitié à l'aide d'une base forte.
2. Donner les caractéristiques d'une solution tampon.
Une solution tampon modère les variations de pH suite à l'ajout modéré
d'une base forte ou d'un acide fort, suite à une dilution.
3.
Réalisation d'une solution tampon à pH = 8,4 à partir d'une solution de
soude à 0,15 M et d'une solution d'acide phosphorique à 0,1 M.
3.1. Quel volume de
solution de soude commerciale concentrée à 40 % en masse ( densité = 1,43) à prélever
pour préparer 1 L de solution de soude à 0,15 M.
1 L de solution comprend 1430 x0,40 =572 g de soude soit 572 / M(soude) = 572 / 40 = 14,3 mol / L.
Facteur de dilution : 14,3 / 0,15 =95,3.
Volume à prélever : 1000 / 95,3 =10,5 mL.
3.2.
Quel volume de solution de soude à 0,15 M faut-il ajouter à 250 mL
d'acide phosphorique à 0,1 M pour obtenir une solution tampon à pH =
8,4 ?
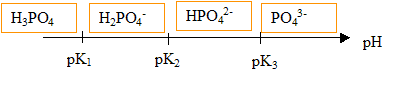
On rappelle les pK a successifs de l'acide phosphorique (2,2 ; 7,2 ; 12,3 ).
Couples acide / base :
pK 1
(H 3PO 4 /
H 2PO 4-) = 2,2 ;
pK 2 (H 2PO 4- /
HPO 42-) = 7,2 ; pK 3
(HPO 42- / PO 43-
) = 12,3 ;
Pour doser la première acidité, il faut 0,1 x0,25 = 0,025 mol de soude soit 0,025 /0,15 =0,167 L. Hypothèse : à pH =8,4 les espèces H 2PO 4- notée A et
HPO 42- notée B sont majoritaires ; le couple (B /
A) fixe le pH.
pH = pKa 2 + log ([B ] / [A ]) ; log ([B ] / [A ]) = 8,4-7,2 = 1,2.
[B] / [A] =15,8 ; [A]= [B]/ 15,8 =0,063 [B] soit nA = 0,063 nB.
De plus n A + n B = 0,1 x0,25 =0,025 mol.
0,063 n B+n B = 0,025 ; n B =0,0235 mol.
n soude = 0,0235 mol ; V soude =0,0235 / 0,15=0,157 L.
Volume total de soude : 0,167 +0,157 ~0,32 L.
3.3. Quelles sont les électrodes à utiliser pour un pHmètre ? Comment étalonner le pHmètre ?
Electrode combinée : électrode de verre et électrode de référence au calomel.
L'électrode de verre peut modifier ses propriétés au cours du temps. On étalonne le pHmètre :
Sortir la sonde de l'eau distillée et l'essuyer avec du papier Joseph.
Plonger la sonde dans une solution tampon à pH = 7. Régler le bouton de température pour que l'appareil indique pH =7.
Sortir la sonde et la rincer avec de l'eau distillée ; l'essuyer.
Plonger la sonde dans une solution tampon à pH = 4. Régler le bouton d'étalonnage pour que l'appareil indique pH =4.
Sortir la sonde et la rincer avec de l'eau distillée ; l'essuyer.
On procède à une extraction liquide/liquide par 5 mL d'un mélange dichlorométhane / isopropanol / n-heptane ( 50 /17/33,v/v/v)
4. Quel est le principe de l'extraction liquide / liquide ?
L'extraction consiste à transferer de la façon la plus sélective possible une espèce d'une phase à une autre.
Les solvants ne doivent pas être miscibles.
La substance à extraire doit être très soluble dans un solvant, et peu soluble dans l'autre solvant.
5. Que signifie ( 50 /17/33,v/v/v) ?
Proportion en volume de chaque espèce dans le mélange de solvants ( dichlorométhane, isopropanol, n-heptane).
6. Que signifie l'acronyme FDS ?
Fiche de données de sécurité.

Que signifie DL 50 ?
Dose létale ; quantité d'une matière administrée en une seule fois causant la mortalité de 50 % du groupe d'annimaux d'essai.
Quel solvant est le plus toxique ?
dichlorométhane (DL50 =2000 mg /kg) ou n heptane (DL50 = 3 000 mg / kg).
7. Dans le bouchon du récipient, quel matériau est responsable de l'étanchéité et lequel de l'inertie chimique ?
Etanchéité : septum en silicone ; inertie chimique : film en PTE.
8. Principe d'un appareil IRTF.
La
Spectroscopie Infrarouge à Transformée de Fourier (FTIR) est basée sur
l'absorption d'un rayonnement infrarouge par le matériau analysé. Elle
permet via la détection des vibrations caractéristiques des liaisons
chimiques entre deux atomes d'effectuer l'analyse des fonctions
chimiques.
La spectrométrie IRTF est basée sur l'obtention dans le domaine
temporel d'un interférogramme à l'aide d'un interféromètre de
Michelson. Le spectre désiré est ensuite obtenu par transformée de
Fourier de cet interférogramme.
9. Sur un spectre IR, à quoi correspond l'axe des abscisses et l'axe des ordonnées ?
Nombre d'onde, inverse d'une longueur d'onde ( cm-1) en abscisse.
Transmittance, sans unité ( en pourcentage ) axe des ordonnées.
10. Donner une bande d'absorption caractéristique du PE, du PTFE et du silicone.
11. Identifier les spectres.
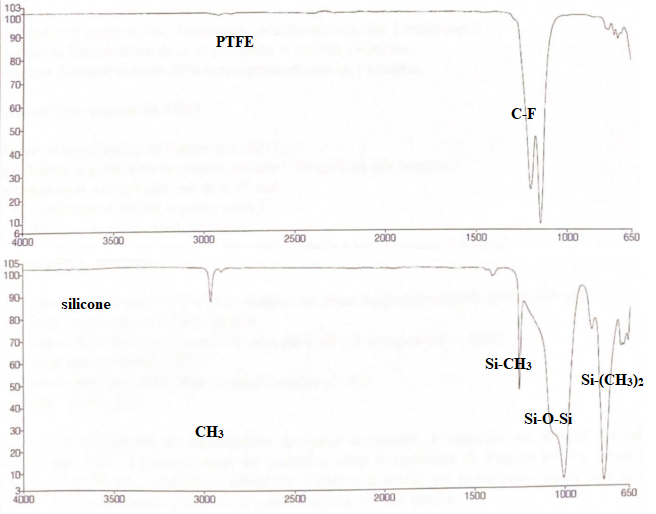
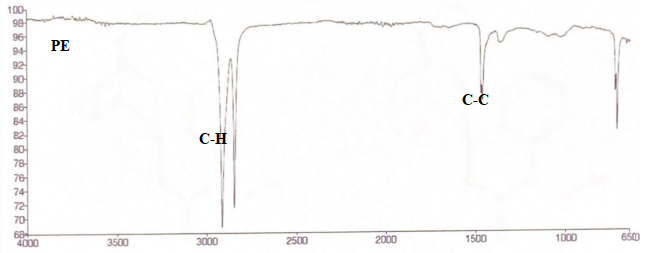
12. Quelle fonction différencie les 2 molécules suivantes ?
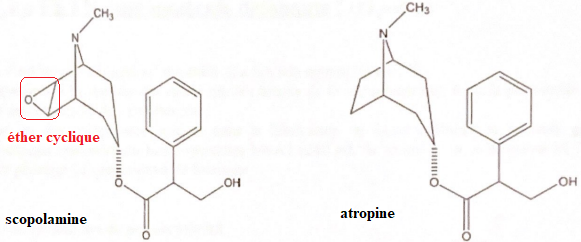 13.
13. Donner les formules brutes.
scopolamine : C 17H 21O 4N ; atropine : C17H23O3N.
14. Calculer leur masse molaire :
scopolamine : 303 g/mol ; atropine : 289 g / mol.
15. Que signifie HPLC ?
Chromatographie en phase liquide haute performance.
16. Que dire de la polarité de la colonne C18 ? De quoi est-elle remplie ?
Colonne apolaire : greffage d'une chaîne carbonnée de 18 carbones sur le gel de silice.
17. Le temps mort expérimental est de 0,45 min. Comment se définit le temps mort ?
C'est le temps que met la phase mobile ( l'éluant) pour traverser la colonne.
Calculer le temps mort théorique.
Diamètre de la colonne D = 0,21 cm ; longueur : 5,0 cm ; volume :3,14 x0,21 2 / 4 x5 =0,173 cm 3.
Débit 0,3 mL / min ; temps mort théorique : 0,173 / 0,3 =0,58 min.
18. Si la
longueur de la colonne est doublée, quelle conséquence cela va t-il
avoir sur la pression du système ? Et sur le temps de rétention ?
Pression inchangée et temps de rétention doublé.
19. Expliquer le principe de l'étalonnage interne.
20. Quels sont les critères pour choisir un étalon interne ?
L'étalon interne doit être chimiquement proche du ou des composés à
analyser, mais être absent de l'échantillon. La concentration de
l'étalon interne est connue.
L'étalon interne permet de s'affranchir de la connaisssance du volume injecté. Le pic de l'étalon interne sert d'échelle.
22. Que signifie ESI+ ?
Ionisation par électronébuliseur : dispersion d'un liquide sous forme de gouttelettes chargées.
23. Citer une autre source d'ionisation utilisable en HPLC MS/MS.
APCI : ionisation chimique à pression atmosphérique.
EI : electron ionisation ( ionisation forte.
CI : chemical ionisation ( ionisation douce )
24.
Sur le spectre de masse de la scopolamine, un pic correspond à 304 m
/z. Donner la formule brute de cet ion. Comment est appelé ce pic ?
Pic moléculaire C17H22O4N+.
25.
Donner les temps de rétention des deux molécules. Expliquer en quoi
correspond une transition MRM. Que représentent les deux chiffres de la
transition 304 --> 138 ?
L'ion précurseur ABCD+ sélectionné par la première étape de la spectrométrie de masse se dissocie par deux voies formant soit AB+, soit CD+ ; ces ions sont sélectionnés séquentiellement par MS2 ( seconde étape de la spetrométrie de masse) et détectés.
|
...
|
....
|
Le PETN C5H8N4O12.
26. A quoi correspond le n°CAS ?
Numéro d'enregistrement unique auprès de la banque de données du Chemical Absracts Service.
27. Ecrire l'équation -bilan de la décomposition du PETN.
C5H8N4O12 --> 2N2(g) + 4H2O(g) +3CO2(g) +2CO(g).
28. Calculer l'enthalpie standard de cette réaction.
DHr =2 DHf(N2) +4 DHf(H2O) +3 DHf(CO2) +2DHf(CO) -DHf(C5H8N4O12)
DHr =2*0+4*(-241,83)+3*(-393,51)+2*(-111,52)-(-370,9)~ -2000 KJ / mol. Réaction exothermique.
29.
100 g de PETN explosent dans une enceinte de 1 L à 298 K. La
température finale est Tf =1500 K. Déterminer la pression finale
atteinte dans l'enceinte. Conclure.
n = 100 / M(PETN) =100 / 361=0,277 mol.
Quantité de matière totale des produits gazeux : 0,277 x(2+4+3+2)=3,05 mol.
P = nRT / V = 3,05 x8,314 x1500 / 10-3 =3,8 107 Pa = 38 bar. L'enceinte se brise.
30. Rappeler le principe de la chromatographie en phase gazeuse.
Un
fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A
l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De
ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un
détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
31. A quoi correspondent les différentes dimensions de la colonne ?
Longueur : 6 m; diamètre 0,53 mm.
32. Quel est le mode de fonctionnement du four ? Quel est son intérêt ?
Type chaleur tournante dont la température est précisément ajustable.
33. Le gaz vecteur est de l'helium. Quels autres gaz vecteur peut-on utiliser ?
argon, hydrogène, azote.
34. Le détecteur utilise une source scellée de 63Ni, émettrice de ß-. Sa détention nécessite une déclaration auprès de l'ASN et de l'IRSN. A quoi correspondent ces abréviations ?
ASN : agence de sécurité nucléaire ;
IRSN : institut de radioprotection et de sureté nucléaire.
Isotope : deux isotopes ne diffèrent que par leurs nombre de neutrons.
6328 Ni --> 6329Cu + 0-1e ( électron).
35. Expliquer le fonctionnement du détecteur ECD.
Un ECD est constitué de deux électrodes avec un courant passant entre
elles. Si un échantillon passe entre les électrodes, les molécules
capturent des électrons, produisant une diminution du courant. celle-ci
est enregistrée sous forme d'un pic positif.
36. Citer un autre détecteur utilisé en chromatographie en phase gazeuse.
Spectromètre de masse ; détecteur UV visible.
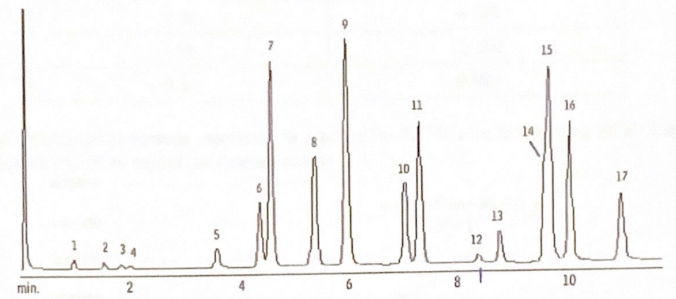
37.
Quel terme de chromatographie peut-être utilisé pour caractériser les
pics 14 et 15 ? Quelle grandeur issue d'un calcul permet de quantifier
ce terme ?
Les temps de rétention sont à peu près identiques.
Le facteur de rétention k = (tri -tm) / tm.
38. Proposer deux solutions permettant potentiellement d'améliorer la séparation de ces deux pics.
La température de la colonne joue de façon prépondérente sur la rétention.
Modifier le débit de la phase mobile.
39. Un échantillon d'une charge explosive est analysé. Son analyse GC-ECD donne trois pics :
Nitrotoluène : tr = 2,06 min ; surface du pic 6505.
3,4-dinitrotoluène : tr = 5,98 min; surface du pic : 12457.
PETN : tr = 8,32 min ; surface du pic : 9802.
La droite d'étalonnage suvante représente la réponse du PETN avec le
détecteur ECD. Calculer la concentration en PETN en mg / mL de
l'extrait obtenu.
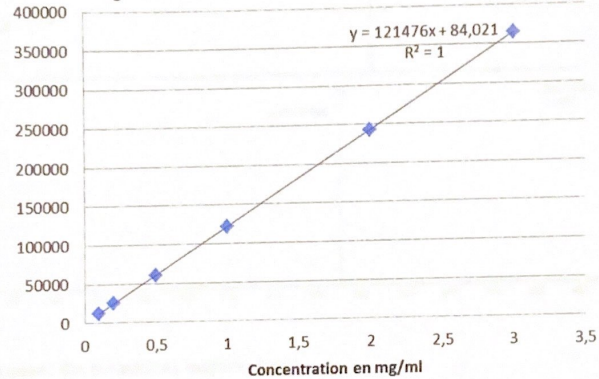
9802 = 121476 x +84,021 ; x ~0,08 mg / mL.
40. Volume de l'extrait : 10 mL ; masse de la prise d'essai de départ : 10 g.
0,8 mg dans 10 mL ; 0,8 mg dans 10 g soit 80 mg / kg.
Le PETN étant majoritaire dans la composition de la charge, cette dernière est dégradée.
|
ane.
|
|
|






