Chimie, concours technicien de la police
technique et scientifique
2021 nord.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
QCM ( 8 points).
1. 2311Na.
Le noyau comporte 11 protons et 23-11=12 neutrons.
2. La configuration électronique de
l'atome d'aluminium 13Al dans son état fondamental est :
1s2
2s2 2p6 3s2 3p1.
3. La formule brute
de l'éthanol est C2H5OH.
4. La molécule suivante est un
aldehyde..
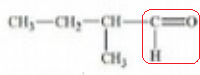 5.
5. Représentation
de Lewis de l'acide éthanoïque : 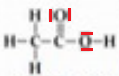 6. Ce modèle moléculaire
6. Ce modèle moléculaire 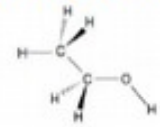 est celui de la molécule de l'éthanol. est celui de la molécule de l'éthanol.
7. L'arrangement du
carbone 1 de l'ion éthanoate 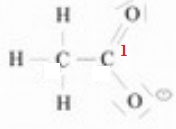 selon la méthode VSEPR
est AX3. selon la méthode VSEPR
est AX3.
8. L'unité
usuelle de la concentration masique est g L-1.
9. Pour préparer
100 mL d'une solution aqueuse de concentration 1,80 g / L, il faut
peser 0,180 g de saccharose.
10. La vitesse
d'une réaction augmente généralement avec la température..
11.
Le temps de demi-réaction t½ est la durée au bout de laquelle
l'avancement est égal à la moitié de l'avancement final.
12. Le pH-mètre est
constitué d'une sonde reliée à un boitier électronique.
13. La relation pH = - log[H 3O +] est
équivalente à [ H3O+] = 10-pH
mol / L.
14. L'ion hydroxyde
HO - est la base conjuguée de H 2O.
15. L'eau est une
espèce amphotère ; elle peut se comporter comme un acide ou comme une
base.
16. 2H2O(l) --> H3O+aq
+ HO-aq; constante d'équilibre Ke =[H3O+aq][HO-aq]=10-14.
17. pKe = - log
(Ke).
18. Expression de
la constante d'acidité du couple NH 4+aq / NH 3aq
:
NH4+aq
+H2O =NH3 aq + H3O+aq
; Ka = [ NH3 aq] [ H3O+aq]
/ [ NH4+aq]
19. On veut doser 10,0 mL d'une
solution A d'acide de concentration Ca inconnue par une solution de
soude de concentration Cb = 0,20 mol/L. Pour prélever 10,0 mL de la
solution A on utilise une pipette jaugée.
20. Pour réaliser
un dosage on utilise une burette graduée.
21. La formule de
la solution aqueuse de soude est Na+aq +HO-aq.
22. On a dosé 10,0
mL d'une solution acide A par 15,0 mL de solution de soude de
concentration Cb = 0,20 mol/L. La concentration de la solution A est :
Cb Véqui / V =15,0 x 0,20 / 10,0=0,30 mol / L
23. Les deux
demi-équations redox suivantes ont lieu lorsqu'une pile fonctionne.
Fe(s) = Fe2+aq + 2e-.
Cu2+aq +2e- = Cu(s).
L'équation de la réaction d'oxydoréduction s'écrit : Fe(s) +Cu2+aq--> Fe2+aq
+Cu(s).
24. La réaction suivante :Fe2+aq +Zn(s)-->Fe(s) +Zn2+aq
Réaction d'oxydoréduction mettant en jeu les couples Zn2+aq
/ Zn(s) et Fe2+aq
/ Fe(s). Réduction des ions Fe2+aq.
25.
Relation des gaz parfaits PV = nRT.
Sous la pression P = 780 hPa et une température de 18°C, une masse de
gaz m =0,240 g occupe un volume V = 162 mL.
Quantité de matière de ce gaz : PV = nRT ; n = PV /
(RT).
P = 7,8 104 Pa ; V = 0,162 L = 1,62 10-4 m3
; T = 273 +18 =291 K.
n = 7,8 104 x1,62 10-4 /(8,31 x291)=5,2 10-3
mol.
Masse molaire de ce gaz : n = m / M ; M =m / n = 0,24 /(5,2 10-3)~46
g / mol.
|
...
|
....
|
Absorption de l'alcool.5 points.
L'alcool est d'abord transformé en éthanal puis l'acétaldehyde est métabolisé en acétate ( acide acétique).
1. A l'instant t=0, une personne avale 500 mL de vin contenant 2 moles d'alcool pur par litre.
Masse volumique de l'éthanol : 0,80 g / mL ; M(éthanol) = 46 g / mol.
a. Calculer le degré alcoolique de ce vin.
masse d'éthanol : m = 1 x46 = 46 g. Volume éthanol : 46 / 0,80 =57,5 mL.
n = 100 x Valcool / Vvin = 100 x 57,5 / 500 =11,5°.
t(min)
|
0
|
2
|
4
|
6
|
10
|
20
|
Concentration C (mol/L) de l'alcool
dans l'estomac
|
2
|
1,42
|
1
|
0,72
|
0,36
|
0,05
|
2. Vitesse moyenne de disparition de l'éthanol dans l'estomac v=- dC / dt.
Soit entre les dates t =6 min et 10 min : v = (0,72-0,36) / 4 =0,090 mol L-1 min-1.
On suppose qu'entre 6 et 10 min cette vitesse est pratiquement
constante. A quelle date la concentration d'alcool dans l'estomac
est-elle égale à 0,50 mol / L ?
Dt = - DC / v =(0,72-0,50) / 0,09 =2,44 min ou 2 min 27 s.
6 +2 min 27 s = 8 min 27 s.
3. 20 min après
avoir avalé la boisson, la majeur partie de l'alcool est dans le sang.
La concentration de l'alcool dans le sang est C0 = 0,025 mol / L.
La personne peut-elle conduire ?
C0 M(éthanol) = 0,025 x46 =1,15 g / L, valeur supérieure à 0,50 g/ L : la personne ne doit pas conduire.
La digestion de l'alcool est un p^rocessus enzymatique. Définir les termes catalyseur et enzyme.
Catalyseur : substance aui augmente la vitesse d'une réaction chimique sans apparître dans le bilan.
Enzyme : protéine présente dans les cellules qui facilite les réactions chimiques qui s'y produisent.
On considère que la vitesse de disparition de l'alcool dans le sang est constante et vaut 7,0 10-5 mol L-1min-1.
Au bout de combien de temps la personne sera t-elle autorisée à conduire ?
0,50 / 46 = 1,09 10-2 mol / L.
0,025-1,09 10-2=1,41 10-2 mol / L
1,41 10-2 / (7,0 10-5) ~ 202 min ou 3 h 22 min.
3 h 22 min + 20 min = 3 h 42 min.
Couple acide / base. 7 points.
pKa ( CH3COOH / CH3COO-) = 4,8.
Soit une solution S1 d'acide acétique de concentration C1 = 0,020 mol / L.
1. Rappeler la définition d'un acide et d'une base.
Un acide est une espèce susceptible de libérer un ion H+aq.
Une base est une espèce susceptible de gagner un ion H+aq.
2. Equation de la réaction de cet acide avec l'eau.
Couples CH3COOH / CH3COO- et H3O+/H2O.
CH3COOH +H2O --> CH3COO- +H3O+.
3 Calculer la constante K1 de cette réaction et conclure.
K1 = [CH3COO-][H3O+] /[CH3COOH] =10-4,8, valeur très faible, la réaction est partielle. L'acide acétique est un acide faible.
4. La mesure du pH donne 3,2. Calculer le coefficient de dissociation de cet acide.
[CH3COO-] / C1 =[H3O+] / C1 =10-3,2 / 0,02 ~0,03 << 1. Il s'agit bien d'un acide faible.
On dissout 0,2 g de soude dans 200 mL d'eau pure. Soit S2 la solution obtenue. Le pH de cette solution est 12,4 à 25°C.
1. Quel est le solvant et quel est le soluté.
Solvant : eaau ; soluté : hydroxyde de sodium.
2. Calculer la concentration C2 et vérifier que [OH-] = C2.
M(NaOH) = 40 g / mol ; n = 0,2 / 40 = 0,005 mol ; C2 = 0,005 / 0,200 =0,025 mol / L.
pOH = 14 -pH = 14-12,4 =1,6 ; [OH-] = 10-1,6 =0,025 mol / L.
On mélange une solution d'acide acétique (V = 10 mL) avec de
l'hydroxyde de sodium. Placer sur une échelle des pKa les couples en
présence.
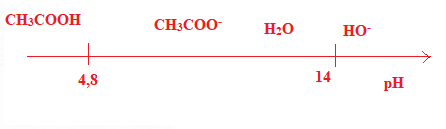
On a tracé la courbe pH = f (Vsoude).
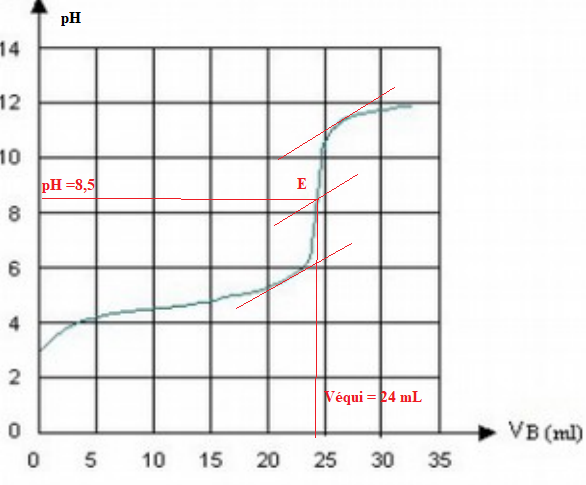
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
C2 Véqui =V Ca ; Ca = 0,025 x 24 / 10 =0,06 mol / L.
|
ane.
|
|
|