Dosage pHmétrique, acide phosphorique.
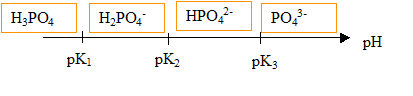
1. On rappelle les pK
a successifs de l'acide phosphorique (2,2 ; 7,2 ; 12,3 ).
Couples acide / base :
pK
1
(H
3PO
4 /
H
2PO
4-) = 2,2 ;
pK
2 (H
2PO
4- /
HPO
42-) = 7,2 ; pK
3
(HPO
42- / PO
43-
) = 12,3 ;
H3PO4 + H2O =
H2PO4- + H3O+. Ka1 = [H2PO4-][H3O+] / [H3PO4].
H2PO4- +H2O =
HPO42-+ H3O+. Ka2 = [HPO42-][H3O+] / [H2PO4-].
HPO42- +H2O= PO43- +H3O+. Ka3 = [PO43-][H3O+] / [HPO42-].
2. Tracer le diagramme de prédominance.
On prépare une solution S en prélevant 10 mL de la solution X qu'on
introduit dans une fiole jaugée de 1 L et on complète vec de l'eau
distillée. Dans un becher, on introduit 20 mL de la solution S à
laquelle on ajoute 30 mL d'eau distillée. On dose par une solution de
soude de concentration Cb = 0,15 mol / L.
3. Quelle type d'électrodes faut-il utiliser ?
Electrode de verre et électrode de référence au calomel.
4. Ecrire les réactions susceptibles d'avoir lieu lors du dosage et calculer leur constante d'équilibre. Interpréter.
H3PO4aq + HO-aq = H2PO4-aq + H2O(l).
K1 = [H2PO4-aq] / ( [H3PO4aq][HO-aq]) = Ka1 / Ke = 10-2,2 / 10-14 =6,3 1011; valeur élevée, la réaction est totale.
H2PO4-aq+ HO-aq = HPO42-aq + H2O(l).
K2 = [HPO42-aq] / ( [H2PO4-aq][HO-aq]) = Ka2 / Ke = 10-7,2 / 10-14 =6,3 106; valeur élevée, la réaction est totale.
HPO42-aq +HO-aq =PO43- + H2O(l).
K3 = [PO43-] / ( [HPO42-aq][HO-aq]) = Ka2 / Ke = 10-12,3 / 10-14 =50; valeur faible, la réaction est partielle.
5. IOn observe deux sauts de pH. VE1 = 16,1 mL ; VE2 = 32,2 mL.
Ecrire les relations aux deux équivalence et en déduire la concentration de la solution X.
VE1 Cb = Cx * 20 ; Cx = 16,1 x0,15 / 20 =0,12 mol / L.
VE2 Cb = 2* Cx * 20 ; Cx = 32,2 x0,15 / 40 =0,12 mol / L.
Tenir compte de la dilution au centième.
0,12 x100 = 12 mol / L.
6. Un bidon d'acide phosphorique porte les indications " concentré à 75 % ; densité 1,58 g / mL.
M(acide phosphorique) = 98 g / mol.
Masse de 1 L : 1,58 kg ; masse d'acide phosphorique : 1,58 x0,75 =1,185 kg.
Concentration : 1 185 / 98 ~12 mol/ L ( identique à la solution X).
7. Quel indicateur coloré aurait-on pu utiliser pour réaliser ce dosage par la méthode colorimétrique ?
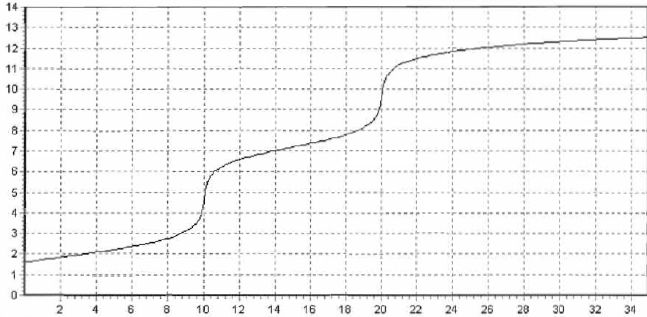
pH de la première équivalence 5 ; de la seconde 10.
Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré :
rouge de méthyle, vert de bromocrésol pour la première équivalence ; jaune d'alizarine pour la seconde.
Analyse de peinture.
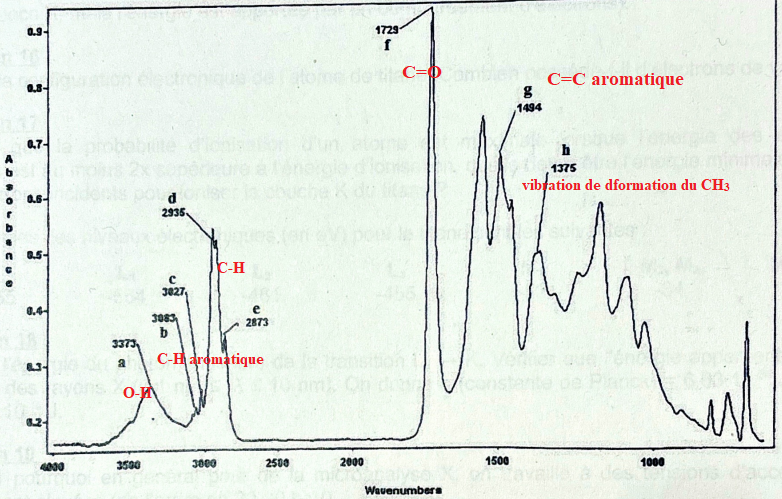
8. Expliquer le
principe de la spectrométrie infra-rouge.
Elle permet de mettre en évidence la présence d’une liaison
particulière. Dans une molécule, les liaisons chimiques peuvent être
décrites comme des ressorts liant les atomes.
Lorsqu’une molécule absorbe de l’énergie sous la forme d’un rayonnement
infrarouge, les atomes se mettent à vibrer. Ils entrent alors en
oscillation.
Lorsqu’une longueur d’onde l correspond
à la fréquence d’excitation d’une liaison chimique, l’énergie du
rayonnement est absorbée par la molécule. La mesure de l’intensité de
lumière absorbée à chaque longueur l conduit
à un spectre caractéristique du produit étudié ; ce spectre présentant
des bandes d’absorption correspondant à l’excitation de certaines
liaisons chimiques.
9. Soit la molécule A-B, constituée de deux atomes de masses respectives ma et mb, unis par une liaison covalente.
On s'intéresse maintenant aux vibrations d'une molécule diatomique
hétéronucléaire. Pour modéliser ces vibrations, on considère que chaque
atome se déplace dans un mouvement harmonique. La liaison est
représentée par un ressort sans masse de raideur k qui relie les deux
atomes 1 et 2 de la molécule. On note Ox l'axe parallèle à la liaison, x
1(t) représente à l'instant t la position de l'atome 1 de masse m
1, et x
2(t) représente celle de l'atome 2 de masse m
2.
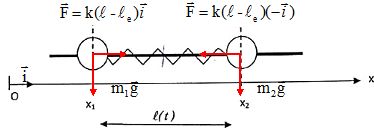
On note l(t) la distance entre les atomes à l'instant t et le la distance à l'équilibre.
Chaque atome est soumis à une force de rappel et à son poids.
Sur un axe horizontal la seconde loi de Newton s'écrit pour l'atome 1: k(l-le) = m1x"1.
Pour l'atome 2 : -k(l-le) = m2x"2.
l(t) =x2(t) -x1(t) ; l"(t) =x"2(t) -x"1(t).
Le mouvement vibratoire peut être décrit par l'équation : µ
l"(t)=-k(
l-
le) , où l'on introduit la masse réduite µ = m
1m
2/(m
1+m
2).
l"(t) =-k(
l-
le) / m
2-k(
l-
le) / m
1 ; l"(t) =-k(
l-
le)( 1/m
1+1/m
2).
l"(t) =-k(
l-
le) (m
1+m
2 ) / (m
1 m
2) =-k(
l-
le) /µ.
Expression de la période Tvib et de la fréquence de vibration fvib du système en fonction de µ et k.
T
vib =2
p(µ/k)
½ ; f
vib = 1/T
vib = 1/(2
p)(k/µ)
½.
10. Comment évolue la fréquence d'oscillation d'une liaison si celle-ci est conjuguée par rapport à la même liaison non conjuguée ?
La conjugaison se traduit par une diminution des nombres d'onde ( relachement de la force des liaisons multiples).
11. Quelle est la relation entre absorbance A et la transmittance T ?
A = log (1/ T) = - log(T).
12. Dans un spectre IR, que représente l'axe des abscisses et quelle est son unité ?
Nombre d'onde ( cm
-1), inverse de la longueur d'onde.
13.
14.

Microanalyse X.
15. Expliquer le phénomène d'émission d'un photon X.
On
obtient des rayons X par bombardement de la matière, généralement un
métal, par des électrons. Lors de l'interaction, l'électron
pénètre dans le métal de la cible où il subit une décélération brutale.
La perte d'énergie cinétique de l'électron est convertie à 99 % en
énergie thermique et à 1 % en rayonnement X.
16. Donner la configuration électronique de l'atome de titane.
Le n° atomique Z vaut Z= 22, donc 22 électrons.
1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Le niveau n= 4 est partiellement occupé, l'élément titane appartient à la 4
ème ligne ( période) de la classification périodique.
4s2 3d2 : 4 électrons externes, le titane appartient à la 4ème colonne.
17. La probabilité
d'ionisation d'un atome est maximale lorsque l'énergie des électrons
incidents est au moins 2 fois supérieure à l'énergie d'ionisation.
Quelle devra être l'énergie minimale en keV des électrons incidents
pour ioniser la couche K du titane ?
Energie de la couche K du titane : - 4,965 keV.
Energie minimale des électrons incidents : 2 x 4,965 =9,93 keV.
18. Calculer l'énergie du photon émis lors de la transition L2 --> K.
Energie de la couche L2 du titane : - 0,461 keV.
E =4 965 -461 =4504 eV ou 4504 x1,6 10-19 =7,2 10-16 J.
E = h c / l ; l = 6,63 10-34 x 3 108 /(7,2 10-16)=2,8 10-10 m = 0,28 nm ( domaine des rayons X).
19. Expliquer pourquoi pour la microanalyse X on travaille à des tensions d'accélération relativement élevées ( 20 à k eV).
Le maximum de photons d'une énergie donnée est produit pour une tension
d'accélération 2,5 fois supérieure à l'énergie des photons.